|
В.А. Федоренко, Л.М. Голец, Ю.А. Демидчук, Г. Крюгель Львовский университет им. И. Франко, Украина.
В начало...
(Окончание)
Полученные данные позволяют сделать вывод о наличии перестроек нуклеотидных последовательностей в хромосомах мутантов kan12 и genR10. Эти данные не достаточны для установления механизма таких перестроек. Однако очевидно, что обнаруженные перестройки хромосом этих мутантов имеют различный характер и более существенны у нестабильного штамма kan12. Следует отметить, что мы не обнаружили отличий в картинах распределения BamHI, KpnI, PstI и PvuII-фрагментов суммарной ДНК исследуемых штаммов S.kanamyceticus, полученных при их фракционировании в условиях обычного электрофореза (рис. 3, А).
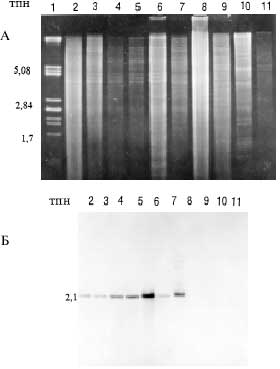 |
Рис. 3. Блот-гибридизация PvuII-фрагментов суммарной ДНК штаммов S.kanamyceticus с DIG-меченным 0,85 т.п.н. SacI-SphI-фрагментом плазмиды pUS8, содержащим ген kmr S.kanamyceticus 1.
А . Электрофореграмма PvuII-рестриктов суммарной ДНК.
Б . Блот-гибридизация.
1 - PstI-фрагменты ДНК фага лямбда; 2 - штамм 1; 3 - 1375; 4 - genR10; 5 - genR8; 6 - genR8.1; 7 - kanC782; 8 - kan12; 9 - S.fradiae 1040; 10 - M.purpurea 1634; 11 - M.zionensis 1611. |
Результаты, полученные при электрофоретическом анализе, позволяют определить размеры хромосомной ДНК исследуемых штаммов S.kanamyceticus как сумму размеров обнаруженных макрофрагментов ДНК. Сумма размеров AseI-фрагментов ДНК штаммов 1 и kanC782 составляет 7788 т.п.н., а DraI-фрагментов - 7715 т.п.н. (см. таблицу). Данные, полученные при использовании двух разных рестриктаз, достаточно хорошо согласуются как между собой, так и с результатами определения размеров хромосомной ДНК других актиномицетов - S.lividans 66 (7901-7970 т.п.н.) [7], S.coelicolor A3(2) (7955-7984 т.п.н.) [5], S.ambofaciens (7915-8265 т.п.н.) [8], S.griseus 2247 (7785-7809 т.п.н.) [9]. В то же время сумма размеров AseI-фрагментов ДНК нестабильного мутанта kan12 составляет 8217 т.п.н., а DraI-фрагментов - 7865 т.п.н. Эти данные позволяют выдвинуть предположение о наличии в хромосоме этого штамма амплификаций нуклеотидных последовательностей. Следует отметить, что и у культуры S.ambofaciens, которая характеризуется высоким уровнем генетической нестабильности, обнаружена существенная разница в размерах генома штаммов, имеющих различное происхождение [6, 8]. В работах других авторов [5, 6, 9] также показано, что эндонуклеазы AseI и DraI лучше всего использовать для физического картирования хромосом актиномицетов. Различия в размерах хромосомной ДНК S.kanamyceticus при анализе DraI- и AseI-фрагментов могут быть обусловлены недостаточной точностью определения размеров крупных фрагментов ДНК. Подобные различия наблюдались и при оценке размеров генома других актиномицетов [6].
Данные о наличии перестроек генома ряда мутантов S.kanamyceticus получены также в экспериментах по ДНК - гибридизации, в которых в качестве зонда использовали 0,85 т.п.н. фрагмент плазмиды pUS8, несущий ген kmr.
После обработки плазмиды pUS8 рестриктазами SacI и SphI были получены шесть фрагментов: 5,06; 2,6; 0,85; 0,71; 0,56 и 0,45 т.п.н. Элюированный из геля и меченый SacI-SphI-фрагмент размером 0,85 т.п.н. был использован как проба для гибридизации. Его гибридизовали с PvuII-фрагментами суммарной ДНК семи штаммов S.kanamyceticus: 1375, 1 и мутантов штамма 1, устойчивых к канамицину и гентамицину - kanC782, kan12, genR10, genR8, genR8.1 [12]. Штамм genR8.1 является спонтанным производным genR8, полученным путем ступенчатой селекции на средах с повышающимися концентрациями канамицина. Уровень канамициноустойчивости genR8.1 превышает таковой штамма genR8 в 5 раз, а исходного штамма 1 - в 100 раз. В качестве контроля указанный фрагмент ДНК гибридизовали с PvuII-фрагментами суммарной ДНК штаммов S.fradiae 1040 (продуцент неомицина), M.purpurea 1634 (продуцент гентамицина) и M.zionensis 1611 (продуцент сизомицина). Полученные данные представлены на рис. 3. Как видно из рис. 3 0,85 т.п.н. SacI-SphI-фрагмент гибридизуется с одним и тем же PvuII-фрагментом суммарной ДНК всех использованных штаммов S.kanamyceticus, размер которого около 2,1 т.п.н. В то же время отсутствует гибридизационный сигнал с суммарной ДНК других продуцентов аминогликозидов - S.fradiae, M.purpurea и M.zionensis. Интенсивность сигнала заметно отличается и при гибридизации с ДНК разных штаммов S.kanamyceticus. Одинаковые, наименее интенсивные сигналы получены с ДНК исходных штаммов 1, 1375 и стабильного Kan--мутанта kanC782, а более сильные сигналы - с ДНК мутантов genR8, genR10 и kan12. Наиболее интенсивный сигнал обнаружен в случае высокорезистентного мутанта genR8.1. Эти данные свидетельствуют об амплификации последовательности ДНК, содержащей ген kmr в геноме мутантов genR10, genR8, genR8.1, kan12, которая наиболее интенсивна у штамма genR8.1. Уровень устойчивости исследуемых мутантов к канамицину и гентамицину, очевидно, коррелирует с числом копий kmr-гена. Результаты гибридизации согласуются с данными о наличии перестроек в хромосомах штаммов kan12 и genR10, полученными и при пульс-электрофорезе макрофрагментов их ДНК (см. рис. 1, таблицу).
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1998-N4, стр. 14-19
1. Голец Л.М., Басилия Л.И., Мазепа А.И., Федоренко В.А. Антибиотики и химиотер 1995; 40: 3-7.
2. Hotta K., Okami Y., Umezawa H. J Antibiot 1977; 30: 1146-1149.
3. Cullum J., Redenbach M., Arnold A. et al. Proc 9th Symp Biol Actinomycet./V.G. Debabov, Y.V. Dudnik, V.N. Danilenko, eds. Moscow 1995; 95-98.
4. Danilenko V.N., Akopiants L.E. Ibid; 104-112.
5. Kieser H.M., Kieser T., Hopwood D.A. J Bacteriol 1992; 174: 5496-5507.
6. Leblond P., Francon F.X., Simenet J., Decaris B. FEMS Microbiol Lett 1990; 72: 79-88.
7. Leblond P., Redenbach M., Cullum J. J Bacteriol 1993; 175: 3422-3429.
8. Leblond P., Fisher G., Francon F.X. et al. Mol Microbiol 1996; 19: 261-271.
9. Lezhava A., Mizukami T., Kajitani T. et al. J Bacteriol 1995; 177: 6492-6498.
10. Redenbach M., Kieser H.M., Denapaite D. et al. Mol Microbiol 1996; 21: 77-96.
11. Pesche U., Fedorenko V., Schumann G. et al. Beijerinck сentenial: microbial physiology and gene regulation: emerging principles and applications. Delf Univ Press./W.A. Schefters and J.P. van Dijken, eds. Delft 1995; 299-300.
12. Демидчук Ю.А., Голец Л.М., Федоренко В.А. Антибиотики и химиотер 1996; 41: 15-20.
13. Hopwood D.A., Bibb M.J., Chater K.F. et al. Genetic manipulation of Streptomyces: A Lab Man. Morwich 1985; 356.
14. Chater K.F., Hopwood D.A. In: Bacillus subtilis and other gram-positive bacteria: Physiol Biochem and Mol Gen. A.L. Sonenstein, ed. Washington 1993; 83-99.
Написать комментарий
|

