|
(Обзор литературы)
В.А. Бурлев, А.С. Гаспаров, Н.С. Аванесян, Н.И. Волков, Д.А. Стыгар РНИЦ акушерства, гинекологии и перинатологии РАМН, Москва
В начало...
(Продолжение)
ФРТ является митогеном для мезенхимальных клеток, но в некоторых исследованиях показано, что и эпителиальные и эндотелиальные клетки также могут отвечать на данный фактор роста [75,87,88]. ФРТ - димерный протеин, состоящий из связанных А и В полипептидных цепей, кодирующихся различными генами. Все три изоформы (АА, АВ, ВВ) изолированы от источника и связываются двумя различными рецепторами. РФРТ-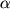 связывает все три изоформы высокой и равной аффинитивностью, тогда как РФРТ- связывает все три изоформы высокой и равной аффинитивностью, тогда как РФРТ- связывает только ФРТ-ВВ с высокой аффинитивностью, а ФРТ-АВ - с низкой. Выявлено что, ФРТ и РФРТ- связывает только ФРТ-ВВ с высокой аффинитивностью, а ФРТ-АВ - с низкой. Выявлено что, ФРТ и РФРТ-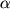 обнаружены в раковых и пограничных опухолях яичников, но не найдены в нормальном яичниковом эпителии. Кроме того, экспрессия РФРТ- обнаружены в раковых и пограничных опухолях яичников, но не найдены в нормальном яичниковом эпителии. Кроме того, экспрессия РФРТ-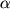 в опухолевых клетках значительно коррелирует со снижением продолжительности жизни, а РФРТ- в опухолевых клетках значительно коррелирует со снижением продолжительности жизни, а РФРТ- не обнаружен в эпителиальных опухолевых клетках [48]. не обнаружен в эпителиальных опухолевых клетках [48].
Структурным аналогом ЭФР, на 30% гомологичным по первичной структуре, взаимодействующим с РЭФР и конкурирующим за него, проявляющим сильное митогенное действие, является ТФР-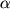 . Доказательством выраженных митогенных свойств является факт обнаружения ЭФР в половине образцов биоптатов рака эндометрия, а ТФР- . Доказательством выраженных митогенных свойств является факт обнаружения ЭФР в половине образцов биоптатов рака эндометрия, а ТФР-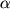 - почти во всех образцах. ТФР- - почти во всех образцах. ТФР-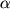 принимает участие в росте и стимуляции дифференциации фолликулов и пролиферации клеток гранулезы. Полагают, что ТФР- принимает участие в росте и стимуляции дифференциации фолликулов и пролиферации клеток гранулезы. Полагают, что ТФР-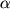 является одним из аутокринных ФР рака яичника. ТФР- является одним из аутокринных ФР рака яичника. ТФР-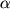 выявлен в резервных и метапластических поверхностных клетках переходной зоны шейки матки. Увеличение экспрессии этого фактора отмечается при инвазивном раке шейки матки. Результаты некоторых исследований позволяют предполагать, что индукторами экспрессии ТФР- выявлен в резервных и метапластических поверхностных клетках переходной зоны шейки матки. Увеличение экспрессии этого фактора отмечается при инвазивном раке шейки матки. Результаты некоторых исследований позволяют предполагать, что индукторами экспрессии ТФР-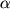 в эпителиальных клетках шейки матки может являться папиллома-вирусная инфекция. Механизмы гормонального контроля ТФР- в эпителиальных клетках шейки матки может являться папиллома-вирусная инфекция. Механизмы гормонального контроля ТФР-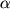 , как и ЭФР, точно не установлены, определенную роль в индукции синтеза ТФР- , как и ЭФР, точно не установлены, определенную роль в индукции синтеза ТФР-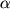 играют андрогены и инсулин. играют андрогены и инсулин.
Семейство ТФР- в настоящее время представлено фактором в настоящее время представлено фактором  1 (впервые обнаружен в тромбоцитах), фактором 1 (впервые обнаружен в тромбоцитах), фактором  2 (выявлен в тромбоцитах, костной ткани и в некоторых клеточных линиях) и фактором 2 (выявлен в тромбоцитах, костной ткани и в некоторых клеточных линиях) и фактором  3 (обнаружен во многих клеточных линиях преимущественно мезенхимального происхождения). ТФР- 3 (обнаружен во многих клеточных линиях преимущественно мезенхимального происхождения). ТФР- - мультифункциональный пептид, который стимулирует так же хорошо, как и ингибирует клеточную пролиферацию и дифферециацию [89]. Экспрессия ТФР- - мультифункциональный пептид, который стимулирует так же хорошо, как и ингибирует клеточную пролиферацию и дифферециацию [89]. Экспрессия ТФР- 1 возрастает при многих опухолях [35], в том числе при раке предстательной железы. В экспериментах с опухолевой трансформацией онкогенами ras и myc показана роль ТФР- 1 возрастает при многих опухолях [35], в том числе при раке предстательной железы. В экспериментах с опухолевой трансформацией онкогенами ras и myc показана роль ТФР- 1 и ТФР- 1 и ТФР- 2 в процессе перехода доброкачественной гиперплазии в злокачественную [91]. 2 в процессе перехода доброкачественной гиперплазии в злокачественную [91].
В 1994 г. R. Henriksen [47] показал, что: а) экспрессия ТФР- повышена в злокачественных опухолях яичников и сравнима с экспрессией в пограничных образованиях и в нормальных эпителиальных клетках; б) экспрессия ТФР- повышена в злокачественных опухолях яичников и сравнима с экспрессией в пограничных образованиях и в нормальных эпителиальных клетках; б) экспрессия ТФР- 3 указывает на позитивную корреляцию с продолжительностью жизни; в) экспрессия ТФР- 3 указывает на позитивную корреляцию с продолжительностью жизни; в) экспрессия ТФР- 1,ТФР- 1,ТФР- рецептор типа 1 или эндоглина в кровеносных сосудах прямо пропорциональна продолжительности жизни, что свидетельствует об антиангиогенной активности ТФР- рецептор типа 1 или эндоглина в кровеносных сосудах прямо пропорциональна продолжительности жизни, что свидетельствует об антиангиогенной активности ТФР- в опухолях яичников. Данные выводы позволят понять патогенез многих опухолей яичников, прогнозировать течение заболевания и осуществлять подбор новых методов лечения. в опухолях яичников. Данные выводы позволят понять патогенез многих опухолей яичников, прогнозировать течение заболевания и осуществлять подбор новых методов лечения.
ФРФ - представитель семейства гепаринсвязывающих факторов роста (ГСФР), которое включает в себя продукты генов ГСФР-1 (кислый ФРФ, или 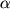 -ФРФ), ГСФР-2 (основной ФРФ, или -ФРФ), ГСФР-2 (основной ФРФ, или  -ФРФ), гена int-2, гена hst (ФРФ саркомы Капоши), а также ФРФ-5, ФРФ-6 и фактор роста кератиноцитов. -ФРФ), гена int-2, гена hst (ФРФ саркомы Капоши), а также ФРФ-5, ФРФ-6 и фактор роста кератиноцитов.
Иммуногистохимически выявлено, что ФРФ локализуется на базальных мембранах средних кровеносных сосудов и на гладкомышечных клетках, на эндотелиальных клетках капилляров и базальной мембране многих тканей, включая эндометрий [34]. Основной ФРФ был найден в экстрактах клеточных линий эндометриальной аденокарциномы, где их секреция регулировалась стероидными гормонами [73]. В частности, секреция основного ФРФ увеличивалась в ответ на 17 -Е2 и ингибировалась пролактином [73]. Эти исследования приводят к тому, что основной ФРФ может быть включен в неоваскуляризацию эндометриальных аденокарцином также хорошо, как и в неоваскуляризацию нормального эндометрия на протяжении всего менструального цикла. В эндометрии нормально функционирующих женщин ФРФ представлен в высокой концентрации, которая не меняется на протяжении всего менструального цикла и увеличивается в атрофичном эндометрии [82]. Эти выводы достаточно странные, если учесть обширную неоваскуляризацию в эндометрии нормально менструирующих женщин и минимальную - атрофичного, постменопаузального. Таким образом, ФРФ находится в эндометриальных железах эпителия [34] и является митогеном в культивированных энометриальных стромальных клетках [53]. Эти исследования вовсе не исключают ФРФ из ангиогенных факторов в эндометрии, хотя в этом процессе могут играть роль другие ФР. ФРФ может быть одним из некоторых ФР, действующих паракринно между железистым эпителием и стромой, и вносит свой вклад в пролиферацию стромы. -Е2 и ингибировалась пролактином [73]. Эти исследования приводят к тому, что основной ФРФ может быть включен в неоваскуляризацию эндометриальных аденокарцином также хорошо, как и в неоваскуляризацию нормального эндометрия на протяжении всего менструального цикла. В эндометрии нормально функционирующих женщин ФРФ представлен в высокой концентрации, которая не меняется на протяжении всего менструального цикла и увеличивается в атрофичном эндометрии [82]. Эти выводы достаточно странные, если учесть обширную неоваскуляризацию в эндометрии нормально менструирующих женщин и минимальную - атрофичного, постменопаузального. Таким образом, ФРФ находится в эндометриальных железах эпителия [34] и является митогеном в культивированных энометриальных стромальных клетках [53]. Эти исследования вовсе не исключают ФРФ из ангиогенных факторов в эндометрии, хотя в этом процессе могут играть роль другие ФР. ФРФ может быть одним из некоторых ФР, действующих паракринно между железистым эпителием и стромой, и вносит свой вклад в пролиферацию стромы.
Таким образом, дисбаланс ФР, образующих сложную систему локальных регуляторов клеточного роста и дифференцировки, их гипо- и гиперпродукция могут провоцировать развитие патологических процессов в различных звеньях репродуктивной системы. Дальнейшее изучение межклеточных взаимодействий в норме и при патологии позволит представить новые перспективы для совершенствования патогенетической терапии патологических состояний, в основе которых лежит активация пролиферативных процессов.
Проблемы репродукции, N3-1998, с.17-25
1. Алиева Э.А. Синдром поликистозных яичников у женщин репродуктивного возраста: Дисс. ... докт. мед. наук. М 1991;366. 2. Балаболкин М.И. Эндокринология. М Медицина. 1989. 3. Бенедиктов Д.И. Лечение и реабилитация больных синдромом склерокистозных яичников: Дисс. ... канд. мед. наук. Свердловск, 1981;189. 4. Ефремова Л.Д. Применение препарата дифенин с целью восстановления репродуктивной функции у пациенток с синдромом поликистозных яичников: Дисс. ... канд. мед. наук. М 1993;130. 5. Жмакин К.Н. Гинекологическая эндокринология. М Медицина.1980;75-77. 6. Accili D., Frapier C., Mosthaf L. et al. A mutation in the insulin receptor gene that impairs transport of the receptor to the plasma membrane and causes insulin-resistance diabetes. EMBO J 1989;8:2509-17. 7. American Fertility Society. Classification of endometriosis. Fertil Steril 1979;32:5-6:633-634. 8. Antczak M., Van Blerkom J., Clark A. A novel mechanism of vascular endothelial growth factor, leptin and transforming growth factor-beta2 sequestration in a subpopulation of human ovarian follicle cells. Hum Reprod 1997;10:2226-2234. 9. Artini P.G., Battaglia C., D' Ambrogio G., Barreca A. et al. Relationship between human oocyte maturity, fertilization and follicular fluid growth factors. Hum Reprod 1994;9:902-906. 10. Barbieri R.L., Makris A., Randall R.W. et al. Insulin stimulates androgen accumulation in incubations of ovarian stroma obtained from women with hyperandrogenism. J Clin Endocrinol Metab 1986;62:904-9. 11. Barbieri R.L., Ryan K.J. Hyperandrogenism, insulin resistance, and acanthosis nigricans syndrome: a common endocrinopathy with distinct pathophysiologic features. Am J Obstet Gynecol 1983;147:90-101. 12 Barbieri R.L., Smith S., Ryan K.J. The role of hyperinsulinemia in the pathogenesis of ovarian hyperandrogenism. Fertil Steril 1988;50:197-212. 13. Baserga R. The biology of cell reproduction. Cambridge (MA): Harvard University Press 1985:46-58. 14. Bennett B., Solar G., Yuan J. et al. A role for leptin and its cognate receptor in haematopoiesis. Curr Biol 1996;6:1170- 1180. 15. Bergh C., Carlsson B., Olsson J.H., Sellskog U., Hillensjo T. Regulation of androgen production in cultured human thecal cells by insulin-like growth factor-I and insulin. Fertil Steril 1993;52:323-31. 16. Berkman R.A., Merrill M.J., Reinhold W.C. et al. Expression of the vascular permeability factor/vascular endothelial growth factor gene in central nervous system neoplasms. J Clin Invest 1993;91:153-159. 17. Berse B., Brown L.F., Van De Water L. et al: Vascular permeability factor (vascular endothelial growth factor) gene is expressed differentially in normal tissues, macrophages, and tumors. Mol Biol Cell 1992;3:211-220. 18. Brannstrom M., Norman R., Seamark R., Robertson S. Rat ovary produces cytokines during ovulation. Biol Reprod 1994;50: 88-94. 19. Brock T.A., Dvorak H.F., Senger D.R. Tumor-secreted permeability factor increased scytosolic Ca2+ and von Willebrand factor release in human endothelial cells. Am J Pathol 1991;38:213-221. 20. Brown L.F., Berse B., Jackman R.W. et al. Increased expression of vascular permeability factor (vascular endothelial growth factor) and its receptors in kidney and bladder carcinomas. Am J Pathol 1993;143:1255-1262. 21. Buyalos R.P., Geffner M.E., Bersch N. et al. Insulin and insulin-like growth factor-I responsiveness in polycystic ovarian syndrome. Fertil Steril 1992;57:796-803. 22. Buyalos R.P., Geffner M.E., Watanabe R.M. et al. The influence of luteinizing hormone and insulin on sex steroids and sex hormone-binding globulin in the polycystic ovarian syndrome. Fertil Steril 1993;60:626-33. 23. Carpenter G., Cohen S. Epidermal growth factor. Annu Rev Biochem 1979;48:193-216. 24. Chang R.J., Nakamura R.M., Judd H.L. et al. Insulin resistance in nonobese patients with polycystic ovarian disease. J Clin Endocrinol Metab 1983;57:356-9. 25. Charnock-Jones D., Sharkey A., Rajput-Williams J. et al. Identification and localization of alternately spliced mRNAs for vascular endothelial growth factor in human uterus and estrogen regulation in endometrial carcinoma cell lines. Biol Reprod 1993;48:1120-1128. 26. Chehab F., Lim M., Lu R. Correction of the cterility defect in homozygous obese female mice by treatment with the human recombinant leptin. Nature Genet 1996;12:318-320. 27. Chehab F., Mounzih K., Ronghua L., Lim M. Early onset of reprodactive function in normal female mice treated with leptin. Science 1997;275:88-90. 28. Christine A., Boocock D. et al. Expression of vascular endothelial growth factor and its receptors flt and KDR in ovarian carcinoma. J Nat Cancer Institute 1995;87:7:506-516. 29. Cioffi J., Shafer A., Zupancic T. et al. Novel B219/OB receptor isoforms: possible role of leptin in hematopoiesis and reprodaction. Nature Med 1996;2:585-589. 30. Cioffi J., Van Blerkom J., Antczak M. et al. The expression of leptin and its receptors in preovulatory human follicles. Mol Hum Reprod 1997;3:467-472. 31. Coldzieher J.W., Green J.A. The polycystic ovary. I. Clinical and histologic features. J Clin Endocrinol Metab 1962;22:325- 38. 32. Connolly D.T., Heuvelman D.M., Nelson R. et al. Tumor vascular permeability factor stimulates endothelial cell growth and angiogenesis. J Clin Invest 1989;84:1470-1478. 33. Considine R., Sinha M., Heiman M., Kriauciunas A. et al. Serum immunoreactive-leptin concentrations in normal-weight and obese humans. New Engl Med 1996;334:292-296. 34. Cordon-Cordo C., Vlodavsky I., Haimovitz-Friedman A., Hicklin D., Fuks Z. Expression of basic fibroblast growth factor in normal human tissues. Lab Invest 1990;63:832-40. 35. Daughaday W.H., Deuel T.F. Endocrinol. Metab Clin N Amer 1991;20:3:539-563. 36. Daughaday W.H., Rotwein P. Insulin-like growth factors I and II. Peptide, messenger ribonucleic acid and gene structures, serum and tissue concentrations. Endocr Rev 1989;10:1:68- 91. 37. Dunaif A., Segal K., Futterweit W., Dobrjansky A. Profound peripheral insulin-resistance, independent of obesity, in polycystic ovary syndrome. Diabetes 1989;38:1165-74. 38. Echternkamp S., Spicer L., Gregory K. et al. Concentrations of insulin-like growth factor-I in blood and ovarian follicular fluid of cattle selected for twins. Biol Reprod 1990;43:8-14. 39. Eden J.A., Jones J., Carter G.D. et al. A comparison of follicular fluid levels of insulin-like growth factor I in normal dominant and cohort follicles, polycystic and multicystic ovaries. Clin Endocrinol 1988;29:327-36.
Далее...
Написать комментарий
| 
