Уравнения Крушева идеальных газов, Зависимости между Q; P; T; V |
Здравствуйте, гость ( Вход | Регистрация )
  |
 30.8.2011, 1:03 30.8.2011, 1:03
Сообщение
#1
|
|
|
уважаемый       Группа: Альтернативщики Сообщений: 146 Репутация: -8 Предупреждения: (0%) 
|
Предлагается на рассмотрение определение зависимостей между тепловой энергией, давлением, температурой и молярным объемом
1. Одним из основных параметров определяющих состояние идеальных газов является молярная тепловая энергия (энергия накопленная одним молем газа). 2. Одним из трех элементарных видов переноса тепловой энергии является тепловое излучение. 3. Определение зависимостей между тепловой энергией, давлением, температурой и молярным объемом является актуальным. Рассмотрим следующий опыт (Назову его -- опыт Крушева, т.к я таких не встречал. Если такие опыты были, то название отменяется.) 1. Возьмем адиабатический сосуд и разделим его на две камеры прозрачной подвижной вакуумной перегородкой (имеющей две стенки с вакуумной прослойкой, как в термосе). 2. Заполним обе камеры идеальным газом. 3. Сместим поршень в сторону. В камерах, в соответствии с адиабатическими процессами, изменятся температуры. 4. Зафиксируем поршень. В результате перехода теплового излучения через прозрачный поршень будут происходить изохорные процессы, пока температуры в обеих камерах не выровняются и не наступит изотермическое равновесие. Изотермическое равновесие может наступить только в том случае, если газы с разных сторон поршня будут иметь одинаковые интенсивности удельного теплового излучения. В адиабатическом сосуде перегороженном подвижным прозрачным вакуумным поршнем можно создать все процессы: адиабатические, изохорные, изотермические, изобарные и анализировать изменения квантово-термодинамических состояний газов. Изменяя молярную тепловую энергию в камерах, можно анализировать зависимости изменения молярных объемов, давлений и температур в адиабатических процессах при разных молярных тепловых энергиях газов. При разных молярных тепловых энергиях газов происходит смещение адиабат: Рис. 1. Изотермы -- красные кривые, адиабаты -- черные кривые. По горизонтальной оси -- объем, по вертикальной оси -- давление. Делая сравнительный анализ зависимостей между изменениями молярной тепловой энергии газов с изменениями молярного объема, давления и температуры, а также сопоставляя с имеющимися законами идеальных газов я получил уравнения, зависимостей между молярной тепловой энергией, молярным объемом, давлением и температурой: kQγ=PVγ, (1) kQγ=RTV(γ-1), (2) Rγ Tγ=kQγ P(γ-1), (3) где Q – молярная тепловая энергия, P – давление, T – температура (молярная интенсивность излучения), V – молярный объем, R – универсальная газовая постоянная, k – коэффициент пропорциональности; γ – показатель адиабаты. Из уравнений видно, что изотермический, изобарический, изохорический и адиабатический процессы могут наблюдаться с различными молярными энергиями, молярными объемами, температурами и давлениями. Данными уравнениями можно определять изменения равновесных состояний идеальных газов при всех термодинамических равновесных процессах, в том числе в термодинамических системах перегороженных вакуумными перегородками. Не знаю, может кто-то такие уравнения уже выводил?? А может я допустил ошибки, но я их не вижу?? Сообщение отредактировал Карандаш - 19.10.2011, 21:54 -------------------- Решать проблемы проще ВМЕСТЕ :drinks:
"Трехмерная гидродинамика и перенос тепла излучением - вот те проблемы, которые должны быть решены для того, чтобы изучать в деталях образование галактик и звезд." //[i] Я. Б. Зельдович С уважением, Карандаш |
 22.9.2011, 16:07 22.9.2011, 16:07
Сообщение
#2
|
|
|
уважаемый       Группа: Альтернативщики Сообщений: 146 Репутация: -8 Предупреждения: (0%) 
|
Цитата(Карандаш @ 21.09.2011, 12:59) * kQγ=PVγ, (1) Пожалуйста, извините в очередной раз за непонятливость, но не мог ли бы кто-то мне объяснить, как из школьных формул PV=RT и dQ=γRdT получить авторскую kQγ=PVγ, (1)? А то у меня размерности почему-то упорно сходятся только при γ=1 и дальше все становится непонятным. Буду весьма признателен. Объясните, пожалуйста, ЧТО это ха формула: dQ=γRdT, откуда вы ее взяли? Откуда в этой формуле гамма перед постоянной? -------------------- Решать проблемы проще ВМЕСТЕ :drinks:
"Трехмерная гидродинамика и перенос тепла излучением - вот те проблемы, которые должны быть решены для того, чтобы изучать в деталях образование галактик и звезд." //[i] Я. Б. Зельдович С уважением, Карандаш |
 22.9.2011, 22:49 22.9.2011, 22:49
Сообщение
#3
|
|
|
супер-элита          Группа: VIP Сообщений: 811 Репутация: 11 Предупреждения: (0%) 
|
Объясните, пожалуйста, ЧТО это ха формула: dQ=γRdT, откуда вы ее взяли? Откуда в этой формуле гамма перед постоянной? Помню со школы. Формула для теплоемкости 1-го моля газа γ= i/2, где i - количество степеней свободы, равное 3 для одноатомных газов, 5 для двухатомных, 7 для трехатомных и т.д. Для 1-й молекулы R заменяется на постоянную Больцмана k, меньшую в число Авогадро раз. -------------------- С уважением,
АИД |
 23.9.2011, 18:22 23.9.2011, 18:22
Сообщение
#4
|
|
|
уважаемый       Группа: Альтернативщики Сообщений: 146 Репутация: -8 Предупреждения: (0%) 
|
Пожалуйста, извините в очередной раз за непонятливость, но не мог ли бы кто-то мне объяснить, как из школьных формул PV=RT и dQ=γRdT получить авторскую kQγ=PVγ, (1)? А то у меня размерности почему-то упорно сходятся только при γ=1 и дальше все становится непонятным. Буду весьма признателен. Помню со школы. Формула для теплоемкости 1-го моля газа γ= i/2, где i - количество степеней свободы, равное 3 для одноатомных газов, 5 для двухатомных, 7 для трехатомных и т.д. Для 1-й молекулы R заменяется на постоянную Больцмана k, меньшую в число Авогадро раз. Начнем с того, что теплоемкость это КОЛИЧЕСТВО ТЕПЛА которое нужно сообщить телу, что бы повысит температуру тела на один градус. Газы, отличаются от твердых и жидких тел тем, что теплоемкость идеального газа зависит от процессов происходящих в идеальном газе. Например: В адиабатическом процессе теплообмена с окружающей средой не происходит. Следовательно, теплоемкость идеального газа в адиабатическом процессе равна нулю. В изотермическом процессе постоянна температура. При изменении объема газу передается (или отбирается) некоторое количество тепла. Следовательно, теплоемкость идеального газа стремится к бесконечности. Цитата как из школьных формул PV=RT получить авторскую kQγ=PVγ, (1)? Если в любом из уравнений (1), (2), (3) заменить молярную энергию через значения молярной энергии из других уравнений то получите уравнение Менделеева-Клайперона. -------------------- Решать проблемы проще ВМЕСТЕ :drinks:
"Трехмерная гидродинамика и перенос тепла излучением - вот те проблемы, которые должны быть решены для того, чтобы изучать в деталях образование галактик и звезд." //[i] Я. Б. Зельдович С уважением, Карандаш |
 23.9.2011, 22:02 23.9.2011, 22:02
Сообщение
#5
|
|
|
супер-элита          Группа: VIP Сообщений: 811 Репутация: 11 Предупреждения: (0%) 
|
Если в любом из уравнений (1), (2), (3) заменить молярную энергию через значения молярной энергии из других уравнений то получите уравнение Менделеева-Клайперона. Может быть. Но вопрос-то ставится, вроде бы, как раз наоборот: Цитата Цитата(АИД @ 22.09.2011, 6:51)
как из школьных формул PV=RT и dQ=γRdT получить авторскую kQγ=PVγ, (1)? А то у меня размерности почему-то упорно сходятся только при γ=1 и дальше все становится непонятным. Сообщение отредактировал АИД - 23.9.2011, 22:07 -------------------- С уважением,
АИД |
 28.9.2011, 13:55 28.9.2011, 13:55
Сообщение
#6
|
|
|
уважаемый       Группа: Альтернативщики Сообщений: 146 Репутация: -8 Предупреждения: (0%) 
|
Молярную тепловую энергию газов можно рассматривать как сумму энергий отдельных атомов и молекул:
Q= NAε Где NA -- число Авогадро, ε – средняя энергия возбуждения одного атома или молекулы. Переход тепловой энергии в виде излучения через вакуумные перегородки требует рассмотрения в процессах термодинамики механизмов КМ. В соответствии с КМ, механизмы приращения тепловой энергии излучения сопровождаются переходами электронов по энергетическим уровням. Следовательно, молярная тепловая энергия газов отдельно взятых элементов прямо пропорциональна средней энергии электронов на возбужденных энергетических уровнях: Q∝E где Q – молярная тепловая энергия излучения; E -- средние энергии электронов на возбужденых энергетических уровнях Это хорошо согласуется с законом сохранения энергии: Эне́ргия — скалярная физическая величина, являющаяся единой мерой различных форм движения материи и мерой перехода движения материи из одних форм в другие. Введение понятия энергии удобно тем, что в случае, если физическая система является замкнутой, то ее энергия сохраняется во времени. Это утверждение носит название закона сохранения энергии. http://ru.wikipedia.org/wiki/%D0%AD%D0%BD%....%B3%D0%B8%D1%8 Зависимость температуры (интенсивности теплового излучения) от давления позволяет предположить, что интенсивность теплового излучения формируется при неупругих ударах атомов. Это хорошо согласуется с МКТ и КМ.  При стремлении давления к нулю, температура тоже стремится к нулю при любых энергиях электронов. Это свидетельствует, что без неупругих ударов электроны на любых энергетических уровнях могут находиться неопределенно долгое время. Для перехода электрона в верх по энергетическим уровням электрон должен захватить фотон с энергией перехода. В соответствии с механизмами неупругих столкновений, для перехода электрона вниз по энергетическим уровням электрон должен получить импульс торможения. Если энергии удара не достаточно для перехода электрона на более низкий энергетический уровень, то удар будет упругим без тормозного излучения. Если нет излучения, то соответственно нет и температуры. Например, при увеличении давления увеличиваются мощности ударов атомов и молекул друг с другом. Это сопровождается увеличением интенсивности тормозного излучения (температуры). Квантовое охлаждение сопровождается излучением тормозного излучения и снижением электронов по энергетическим уровням. Переходы электронов между низкими уровнями имеют большую частоту излучения, следовательно, для переходов электронов требуются большие энергии ударов (давления). Это объясняет механизм зависимостей между энергиями электронов (молярной тепловой энергией), давлением и интенсивностью удельного излучения (температурой). Это хорошо согласуется с определением температуры: ... мерилом температуры является не само движение, а хаотичность этого движения. Хаотичность состояния тела определяет его температурное состояние, и эта идея (которая впервые была разработана Больцманом), что определенное температурное состояние тела вовсе не определяется энергией движения, но хаотичностью этого движения, и является тем новым понятием в описании температурных явлений, которым мы должны пользоваться ... (П. Л. Капица) http://ru.wikipedia.org/wiki/%D0%A2%D0%B5%...%83%D1%80%D0%B0 Рис. 1. Изотермы -- красные кривые, адиабаты -- черные кривые. По горизонтальной оси -- объем, по вертикальной оси -- давление. Является существенным, что в изотермических системах изменение состояний газов сопровождается приращением тепловой энергии. Например, в изотермической системе из двух камер, в которых P1≠P2, соответственно и V1≠V2, молярная тепловая энергия (средние энергии возбуждения электронов) тоже различна Q1≠Q2: V1P1=V2P2, при T1=T2, Q1≠Q2 Является существенным, что в изотермических процессах молярный объем зависит от молярной тепловой энергии (средней энергии электронов на возбужденных энергетических уровнях) и давления. Это можно объяснить тем, что каждый атом или молекула имеют определенный объем, определяемый объемом электронных оболочек атомов, а также кулоновскими силами отталкивания между электронными оболочками соседних атомов или молекул и внешним давлением. Кулоновские силы отталкивания между электронными оболочками атомов и молекул объясняют упругость газов, а также зависимость изменения молярного объема газов от давления: V=f(Q,P) Где f -- функция зависимости между температурой, давлением и молярной тепловой энергией (средней энергией электронов на возбужденных энергетических уровнях). Таким образом, можно сделать вывод, что температура является ВТОРИЧНЫМ фактором от взаимодействий между атомами в зависимости от давления и внутренней тепловой энергии Q (средней энергии электронов на возбужденных энергетических уровнях). T=f(P,Q) где f -- функция зависимости температуры от давления и молярной тепловой энергией (средней энергией электронов на возбужденных энергетических уровнях) В изобарных процессах, тепловая энергия полностью тратится на работу по изменению объема: ∆Q=A=P∆V, при P=constant, Где A -- работа В соответствии с КМ, изменение объемов при приращении тепловой энергии можно объяснить тем, что приращение тепловой энергии излучения сопровождается переходом электронов по энергетическим уровням, что сопровождается изменением объемов электронных оболочек атомов и молекул. Следовательно, можно сделать вывод, что в изобарных процессах приращение тепловой энергии прямо пропорционально приращению молярного объема: Q∝PV, при P=constant. (4) В адиабатических процессах, зависимость температуры от давлений, а так же стремление температуры к нулю при стремлении давления к нулю, при любых средних энергиях возбужденных электронов в атомах, свидетельствует, что: 1. электроны на возбужденных энергетических уровнях могут находиться неопределенно долгое время; 2. температура (интенсивность теплового излучения) определяется интенсивностью неупругих ударов атомов и молекул. В адиабатических процессах, газы имеющие разные молярные тепловые энергии (средние энергии электронов на возбужденных энергетических уровнях) имеют разные адиабаты: Как видно из Рис.1., адиабаты зависят от молярной тепловой энергии в газах, что можно записать как: PVγ=constant=f(Q) или PVγ=f(Q), при Q=constant, (5) Где f – функция зависимости constant от молярной тепловой энергии (средней энергии электронов на возбужденных энергетических уровнях). В адиабатических процессах, по изменениям konstant, в соответствии с изменениями молярной тепловой энергии Q, можно определить функцию зависимости изменения constant в соответствии с изменениями молярной тепловой энергии constant =f(Q). Сообщение отредактировал Карандаш - 23.10.2011, 17:44 -------------------- Решать проблемы проще ВМЕСТЕ :drinks:
"Трехмерная гидродинамика и перенос тепла излучением - вот те проблемы, которые должны быть решены для того, чтобы изучать в деталях образование галактик и звезд." //[i] Я. Б. Зельдович С уважением, Карандаш |
 28.9.2011, 18:39 28.9.2011, 18:39
Сообщение
#7
|
|
|
супер-элита          Группа: VIP Сообщений: 811 Репутация: 11 Предупреждения: (0%) 
|
В адиабатическом процессе теплообмена с окружающей средой не происходит. Следовательно, теплоемкость идеального газа в адиабатическом процессе равна нулю. В изотермическом процессе постоянна температура. При изменении объема газу передается (или отбирается) некоторое количество тепла. Следовательно, теплоемкость идеального газа стремится к бесконечности. В изобарных процессах, тепловая энергия полностью тратится на работу по изменению объема: ∆Q=A=P∆V, при P=constant, В адиабатических процессах, по изменениям konstant, в соответствии с изменениями молярной тепловой энергии Q, можно определить функцию зависимости изменения constant в соответствии с изменениями молярной тепловой энергии constant =f(Q). Бог с ними, теплоемкостями, равными то нулю, то бесконечности, и 100-процентным КПД изобарного процесса, хотя и они тянут на открытия. Каждое. Но эти открытия в теплофизике несомненно меньше по значению открытия в математике функции "зависимости изменения constant в соответствии с изменениями молярной тепловой энергии constant =f(Q)". Или я опять что-то не так понял? Тогда извините еще раз за непонятливость, пожалуйста. -------------------- С уважением,
АИД |
 29.9.2011, 0:10 29.9.2011, 0:10
Сообщение
#8
|
|
|
уважаемый       Группа: Альтернативщики Сообщений: 146 Репутация: -8 Предупреждения: (0%) 
|
Бог с ними, теплоемкостями, равными то нулю, то бесконечности, и 100-процентным КПД изобарного процесса, хотя и они тянут на открытия. Каждое. Любите Вы открытия. Не понял, ЧТО Вы имеете против -- чем Вам не нравятся теплоемкости стремящиеся к 0 и бесконечности?? Цитата Но эти открытия в теплофизике несомненно меньше по значению открытия в математике функции "зависимости изменения constant в соответствии с изменениями молярной тепловой энергии constant =f(Q)". Или я опять что-то не так понял? Тогда извините еще раз за непонятливость, пожалуйста. Спасибо за присвоение моим формулам статуса открытия. Но, Опять не понял. КАКИЕ ко мне претензии и в ЧЕМ?? У Вас ЧТО, на рис.1 большое количество адиабат соответствуют одним и тем же числам constant?? Так же, как каждая изотерма на рис.1 соответствует определенным T=constant, точно также на рис.1. каждая изобара соответствует определенным внутренним тепловым энергиям (средним энергиям электронов на возбужденных энергетических уровнях) Q=constant . Учтите, каждой линии адиабаты, соответствуют отдельные числа в уравнении Пуассона, изменение которых зависит от изначальной внутренней тепловой энергии (средних энергий электронов на возбужденных энергетических уровнях). Например: в опыте Крушева, в изотермической системе из двух камер, в которых при T1=T2, давление P1≠P2, соответственно и молярные объемы V1≠V2, молярная тепловая энергия (средние энергии возбуждения электронов) тоже различна Q1≠Q2. При быстром перемещении поршня в камерах будут происходить адиабатные процессы. В разных камерах, в результате разной молярной тепловой энергии (средних энергий электронов), линии адиабат будут соответствовать разным числам constan1≠tconstant2. Следовательно, на диаграмме будут две разные линии, соответствующие constan1=f(Q1), и constan2=f(Q2). -------------------- Решать проблемы проще ВМЕСТЕ :drinks:
"Трехмерная гидродинамика и перенос тепла излучением - вот те проблемы, которые должны быть решены для того, чтобы изучать в деталях образование галактик и звезд." //[i] Я. Б. Зельдович С уважением, Карандаш |
 29.9.2011, 8:36 29.9.2011, 8:36
Сообщение
#9
|
|
|
супер-элита          Группа: VIP Сообщений: 811 Репутация: 11 Предупреждения: (0%) 
|
Не понял, ЧТО Вы имеете против -- чем Вам не нравятся теплоемкости стремящиеся к 0 и бесконечности?? Я же сказал, бог с ними, что и значит, что я ничего не имею против. Просто я еще нигде не встречал таких утверждений. Кстати, в Вашем предложении мне Для ликбеза, посмотрите теплоемкости при адиабатических и изотермических процессах: http://ru.wikipedia.org/wiki/%D0%90%D0%B4%...%B5%D1%81%D1%81 я не нашел таких значений тоже. Они там конечные почему-то. Да и Ваше утверждение об изобарном процессе почему-то показалось мне больше подходящим для изотермического. Хотя я мог бы частично согласиться с Вами, что термин "теплоемкость" в упомянутых Вами случаях не слишком удачен, так как включает кроме собственно тепла, как энергии неконтролируемого движения молекул, еще и работу контролируемого перемещения частей системы, что может приводить иногда к недоразумениям. Но обычно пользователи знают об этом и по умолчанию исключают-обходят эти недоразумения. Так что, если Вы предложите более корректные-безупречные формулмровки, то Вам будут благодарны все, может быть, за редким исключением. В случае же функций многих переменных условное фиксирование значений некоторых переменных Вы вольны обозначать как угодно (в том числе и "T=constant", "Q=constant"). Но обычно пишут Т=Тi, Q=Qj и т.д., оставляя обозначение "constant" только для подчеркивания этой фиксации, но не как обозначение переменной. Поэтому, например, я тоже не сразу понял, что Вы хотите сказать на своем языке, и попросил уточнения. Согласитесь, без такого уточнения каждый волен думать, что ему удобнее. -------------------- С уважением,
АИД |
 29.9.2011, 8:48 29.9.2011, 8:48
Сообщение
#10
|
|
|
супер-элита          Группа: VIP Сообщений: 811 Репутация: 11 Предупреждения: (0%) 
|
в результате разной молярной тепловой энергии (средних энергий электронов), Да, и не могли бы Вы еще объяснить, что значит это выражение? А то я опять могу что-то не так понять, так как я нигде не встречал еще отождествления тепловой энергии молекул с энергией их электронов.-------------------- С уважением,
АИД |
 29.9.2011, 11:57 29.9.2011, 11:57
Сообщение
#11
|
|
|
уважаемый       Группа: Альтернативщики Сообщений: 146 Репутация: -8 Предупреждения: (0%) 
|
В случае же функций многих переменных условное фиксирование значений некоторых переменных Вы вольны обозначать как угодно (в том числе и "T=constant", "Q=constant"). Но обычно пишут Т=Тi, Q=Qj и т.д., оставляя обозначение "constant" только для подчеркивания этой фиксации, но не как обозначение переменной. Поэтому, например, я тоже не сразу понял, что Вы хотите сказать на своем языке, и попросил уточнения. Согласитесь, без такого уточнения каждый волен думать, что ему удобнее. Я рад, что мы пришли к пониманию друг друга. Без острой необходимости я категорически против ввода новых терминов. Поэтому, разрешите, я все же буду использовать те обозначения которые приняты в учебниках, например, И.В.Савельева, Википедии и т.д. pV = const, при T=const V / T = const при P=const P / T = const при V=const Что то будет не понятно спрашивайте. Цитата Цитата(Карандаш @ 29.09.2011, 0:10) * Не понял, ЧТО Вы имеете против -- чем Вам не нравятся теплоемкости стремящиеся к 0 и бесконечности?? Я же сказал, бог с ними, что и значит, что я ничего не имею против. Просто я еще нигде не встречал таких утверждений. Кстати, в Вашем предложении мне Цитата(Карандаш @ 29.09.2011, 0:10) * Для ликбеза, посмотрите теплоемкости при адиабатических и изотермических процессах: http://ru.wikipedia.org/wiki/%D0%A2%D0%B5%...%B0%D0%B7%D0%B0 я не нашел таких значений тоже. Они там конечные почему-то. Не понимаю, КАК в трех строчках ЧТО ТО не найти?? Адиабатический В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть dQ=0. При изменении объема температура и давление меняются, то есть dT≠0. Следовательно, теплоемкость идеального газа в адиабатическом процессе также равна нулю: Садиаб=0. Изотермический В изотермическом процессе постоянна температура, то есть dT=0. При изменении объема газу передается (или отбирается) некоторое количество тепла. Следовательно, теплоемкость идеального газа стремится к бесконечности: 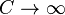 Цитата Да и Ваше утверждение об изобарном процессе почему-то показалось мне больше подходящим для изотермического. Уточните, ЧТО Вы имеете в виду. Цитата Хотя я мог бы частично согласиться с Вами, что термин "теплоемкость" в упомянутых Вами случаях не слишком удачен, так как включает кроме собственно тепла, как энергии неконтролируемого движения молекул, еще и работу контролируемого перемещения частей системы, что может приводить иногда к недоразумениям. Но обычно пользователи знают об этом и по умолчанию исключают-обходят эти недоразумения. Так что, если Вы предложите более корректные-безупречные формулмровки, то Вам будут благодарны все, может быть, за редким исключением. Термин теплоемкости введен не мною, никаких недоразумений в нем я не вижу, меня он вполне устраивает: Теплоемкость идеального газа — это отношение тепла, сообщенного газу, к изменению температуры δТ, которое при этом произошло. 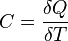 Цитата(Карандаш @ 22.09.2011, 16:07) * Объясните, пожалуйста, ЧТО это за формула: dQ=γRdT, откуда вы ее взяли? Откуда в этой формуле гамма перед постоянной? Помню со школы. Формула для теплоемкости 1-го моля газа γ= i/2, где i - количество степеней свободы, равное 3 для одноатомных газов, 5 для двухатомных, 7 для трехатомных и т.д. Для 1-й молекулы R заменяется на постоянную Больцмана k, меньшую в число Авогадро раз. Уточните, ЧТО у Вас обозначает γ. Из школьного учебника 
Сообщение отредактировал Карандаш - 29.9.2011, 17:41 -------------------- Решать проблемы проще ВМЕСТЕ :drinks:
"Трехмерная гидродинамика и перенос тепла излучением - вот те проблемы, которые должны быть решены для того, чтобы изучать в деталях образование галактик и звезд." //[i] Я. Б. Зельдович С уважением, Карандаш |
 29.9.2011, 19:57 29.9.2011, 19:57
Сообщение
#12
|
|
|
супер-элита          Группа: VIP Сообщений: 811 Репутация: 11 Предупреждения: (0%) 
|
Термин теплоемкости введен не мною, никаких недоразумений в нем я не вижу, меня он вполне устраивает: Неудобство термина "Теплоемкость газа" в том, что его название построено как название свойства самого газа аналогично молекулярному весу, количеству степеней свободы и т.п., предполагающих однозначность понимания. В случае же "теплоемкости газа" одного только названия мало для однозначности сообщения, так как она имеет разные численные значения в разных условиях-процессах. То есть, является характеристикой не только газа, но и процесса, и эти условия должны быть неотъемлемой частью любого сообщения. Теплоемкость идеального газа — это отношение тепла, сообщенного газу, к изменению температуры δТ, которое при этом произошло. Поэтому, разрешите, я все же буду использовать те обозначения которые приняты в учебниках, например, И.В.Савельева, Википедии и т.д. Ради бога, ваше право. Но не забывайте, что есть и другие непонятливые. pV = const, при T=const V / T = const при P=const P / T = const при V=const Не понимаю, КАК в трех строчках ЧТО ТО не найти?? Формальные противоречия с Вашим же определением теплоемкости как количества сообщенного газу тепла. В адиабатическом случае Вы не сообщаете газу тепла и не собираетесь. Но работа выполняется. За счет чего? Обычный ответ - за счет теплоемкости газа. Иначе для параметра-источника энергии-работы требуется другое название. В изотермическом случае внутренняя (тепловая) энергия газа не меняется. Можно ли называть свойством-теплоемкостью газа количество тепла, которое в него не поступает, а если поступает, то тут же теряется? Ведь накопленное ранее тепло существует при достигнутой при накоплении температуре. То есть, та же ситуация - соответствующему свойству газа тоже надо бы подыскать другое название. Или указанным Вами. Адиабатический В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть dQ=0. При изменении объема температура и давление меняются, то есть dT≠0. Следовательно, теплоемкость идеального газа в адиабатическом процессе также равна нулю: Садиаб=0. Изотермический В изотермическом процессе постоянна температура, то есть dT=0. При изменении объема газу передается (или отбирается) некоторое количество тепла. Следовательно, теплоемкость идеального газа стремится к бесконечности: Цитата У Вас написано Да и Ваше утверждение об изобарном процессе почему-то показалось мне больше подходящим для изотермического. Уточните, ЧТО Вы имеете в виду В изобарных процессах, тепловая энергия полностью тратится на работу по изменению объема: Но при постоянном давлении изменить объем можно только повышением температуры с соответствующим увеличением внутренней энергии газа. При неизменной внутренней энергии dT=0, что соответствует изотермическому случаю по определению. ∆Q=A=P∆V, при P=constant, -------------------- С уважением,
АИД |
 29.9.2011, 22:12 29.9.2011, 22:12
Сообщение
#13
|
|
|
уважаемый       Группа: Альтернативщики Сообщений: 146 Репутация: -8 Предупреждения: (0%) 
|
Цитата Цитата(Карандаш @ 29.09.2011, 11:57) * Термин теплоемкости введен не мною, никаких недоразумений в нем я не вижу, меня он вполне устраивает: Теплоемкость идеального газа — это отношение тепла, сообщенного газу, к изменению температуры δТ, которое при этом произошло. Неудобство термина "Теплоемкость газа" в том, что его название построено как название свойства самого газа аналогично молекулярному весу, количеству степеней свободы и т.п., предполагающих однозначность понимания. В случае же "теплоемкости газа" одного только названия мало для однозначности сообщения, так как она имеет разные численные значения в разных условиях-процессах. То есть, является характеристикой не только газа, но и процесса, и эти условия должны быть неотъемлемой частью любого сообщения. Вот здесь вы правильно понимаете, что ТЕПЛОЕМКОСТЬ ГАЗА ЗАВИСИТ ОТ ПРОТЕКАЮЩИХ ПРОЦЕССОВ. В этом плане, теплоемкость газа принципиально отличается от теплоемкости твердых тел. Цитата Цитата Цитата(Карандаш @ 29.09.2011, 11:57) * Не понимаю, КАК в трех строчках ЧТО ТО не найти?? Адиабатический В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть dQ=0. При изменении объема температура и давление меняются, то есть dT≠0. Следовательно, теплоемкость идеального газа в адиабатическом процессе также равна нулю: Садиаб=0. Изотермический В изотермическом процессе постоянна температура, то есть dT=0. При изменении объема газу передается (или отбирается) некоторое количество тепла. Следовательно, теплоемкость идеального газа стремится к бесконечности: Формальные противоречия с Вашим же определением теплоемкости как количества сообщенного газу тепла. В адиабатическом случае Вы не сообщаете газу тепла и не собираетесь. Но работа выполняется. За счет чего? Обычный ответ - за счет теплоемкости газа. Иначе для параметра-источника энергии-работы требуется другое название. В изотермическом случае внутренняя (тепловая) энергия газа не меняется. Можно ли называть свойством-теплоемкостью газа количество тепла, которое в него не поступает, а если поступает, то тут же теряется? Ведь накопленное ранее тепло существует при достигнутой при накоплении температуре. То есть, та же ситуация - соответствующему свойству газа тоже надо бы подыскать другое название. Или указанным Вами. Да и Ваше утверждение об изобарном процессе почему-то показалось мне больше подходящим для изотермического. Цитата Цитата(Карандаш @ 29.09.2011, 11:57) * Уточните, ЧТО Вы имеете в виду У Вас написано Цитата Цитата(Карандаш @ 28.09.2011, 13:55) * В изобарных процессах, тепловая энергия полностью тратится на работу по изменению объема: ∆Q=A=P∆V, при P=constant, Но при постоянном давлении изменить объем можно только повышением температуры с соответствующим увеличением внутренней энергии газа. При неизменной внутренней энергии dT=0, что соответствует изотермическому случаю по определению. А здесь Вы все мешаете в кучу -- и теплоемкость, и работу, и состояния газов. Вы совершенно не понимаете, что работа, теплоемкость газов и состояние газов это разные понятия. СОСТОЯНИЯ ГАЗОВ полностью характеризуются зависимостями между Q, P, V и T, независимо каким образом газы пришли к такому состоянию. Например, равновесным состояниям газов не важно, какие процессы предшествовали данному СОСТОЯНИЮ -- изобарные, изотермические, изохорные или адиабатические, КАКАЯ работа совершалась над газами -- положительная или отрицательная, какое было приращение тепловой энергии и т.д. Именно в этом плане я и определял равновесные СОСТОЯНИЯ газов параметрами Q, P, V и T , без учета работы. Более того. Вам может показаться странным, но температура и молярный объем НЕ ЯВЛЯЮТСЯ ОСНОВНЫМИ параметром состояний газов. Состояния газов ПОЛНОСТЬЮ характеризуются всего двумя ПЕРВИЧНЫМИ параметрами -- внутренней молярной тепловой энергией (средней энергии электронов на возбужденных уровнях в атомах) Q и давлением P. Температура и молярный объем ВТОРИЧНЫ от внутренней молярной тепловой энергии (средней энергии электронов на возбужденных уровнях) и давления. Исходя всего из этих двух параметров определяются все остальные параметры состояний идеальных газов: V∝Q/P, при P=const kQγ=PVγ, RT=VP. Еще раз подчеркну -- температура (тепловое излучение) определяется интенсивностью неупругих ударов атомов. Нет неупругих ударов атомов, нет и температуры. Сообщение отредактировал Карандаш - 30.9.2011, 11:41 -------------------- Решать проблемы проще ВМЕСТЕ :drinks:
"Трехмерная гидродинамика и перенос тепла излучением - вот те проблемы, которые должны быть решены для того, чтобы изучать в деталях образование галактик и звезд." //[i] Я. Б. Зельдович С уважением, Карандаш |
 30.9.2011, 5:55 30.9.2011, 5:55
Сообщение
#14
|
|
|
супер-элита          Группа: VIP Сообщений: 811 Репутация: 11 Предупреждения: (0%) 
|
Более того. Вам может показаться странным, но температура и молярный объем НЕ ЯВЛЯЮТСЯ ОСНОВНЫМИ параметром состояний газов. Состояния газов ПОЛНОСТЬЮ характеризуются всего двумя ПЕРВИЧНЫМИ параметрами -- внутренней молярной тепловой энергией (средней энергии электронов на возбужденных уровнях в атомах) Q и давлением P. Температура и молярный объем ВТОРИЧНЫ от внутренней молярной тепловой энергии (средней энергии электронов на возбужденных уровнях) и давления. Исходя всего из этих двух параметров определяются все остальные параметры состояний идеальных газов: Мне, действительно, кое-что кажется странным, но не то, что Вы называете. Например, мне кажется странным отождествление тепловой энергии атомов и энергии только их возбужденных электронных оболочек. Кажется странным утверждение, что температура определяется интенсивностью только неупругих ударов атомов. Странными кажутся и две первые формулы из трех, противоречащие друг другу. Меня когда-то учили, что теплота газа - это. в первую очередь, кинетическая энергия его молекул. И что неупругими ударами определяется только излучение, но не температура - одна из мер этой энергии, численное значение которой отличается от численного же значения энергии только размерным коэффициентом. И что температура вместе с неупругими ударами является причиной теплового излучения, но не наоборот. Другое дело, что иногда по излучению можно определить температуру и наоборот. Но далеко не всегда, так как для этого надо знать еще много чего, меняющегося от случая к случаю. Например, в экране и индикаторных светодиодах Вашего компьютера и телевизора, в любых лазерах, включая все газовые, или в обычных бытовых люминесцентных лампах и просто в цветных газах. Наконец, если Вашу первую формулу V=Q/P подставить в третью RT=VP, то RT=VP=(Q/P)P=Q, что не совпадает ни с тем, чему учили меня и, подозреваю, Вас тоже, ни с Вашей второй формулой kQγ=PVγ=QVγ-1, откуда Q=V/k1/(γ-1). Не исключено, конечно, что в каком-то частном случае можно подобрать параметры конкретной порции газа так, чтобы Q=V/k1/(γ-1), но Вы ведь, наверное, претендуете на все случаи, так как формулы принято обычно писать для них. Извините меня, пожалуйста, за непонятливость, но именно она заставила меня задавать вопросы. V=Q/P, kQγ=PVγ, RT=VP. Еще раз подчеркну -- температура (тепловое излучение) определяется интенсивностью неупругих ударов атомов. Нет неупругих ударов атомов, нет и температуры. -------------------- С уважением,
АИД |
 30.9.2011, 11:40 30.9.2011, 11:40
Сообщение
#15
|
|
|
уважаемый       Группа: Альтернативщики Сообщений: 146 Репутация: -8 Предупреждения: (0%) 
|
Вы ведь, наверное, претендуете на все случаи, так как формулы принято обычно писать для них. Да, я претендую на написание уравнений для всех равновесных состояний идеальных газов. Цитата Извините меня, пожалуйста, за непонятливость, но именно она заставила меня задавать вопросы. За Ваши вопросы, Вам спасибо. На то и форум, что бы объяснять вопросы. Цитата Мне, действительно, кое-что кажется странным, но не то, что Вы называете. Давайте решать странные вопросы по порядку: Цитата Меня когда-то учили, что теплота газа - это. в первую очередь, кинетическая энергия его молекул. Неправильно Вас учили. Пример. В реактивном двигателе потоки атомов и молекул имеют огромную кинетическую скорость. Но, как только они теряют давление, то и температура прямо пропорционально падает. На больших высотах и в космосе, буквально в нескольких метрах от двигателей наблюдаются конденсационные следы -- конденсат и кристаллизация газов.  Это хорошо согласуется с определением температуры: ... мерилом температуры является не само движение, а хаотичность этого движения. Хаотичность состояния тела определяет его температурное состояние, и эта идея (которая впервые была разработана Больцманом), что определенное температурное состояние тела вовсе не определяется энергией движения, но хаотичностью этого движения, и является тем новым понятием в описании температурных явлений, которым мы должны пользоваться ... (П. Л. Капица)http://ru.wikipedia.org/wiki/%D0%A2%D0%B5%...%83%D1%80%D0%B0 Цитата Например, мне кажется странным отождествление тепловой энергии атомов и энергии только их возбужденных электронных оболочек. Я не зря в опыте Крушева рассматриваю передачу тепловой энергии методом излучения через прозрачный вакуумный поршень. В соответствии КМ, приращение энергии излучения ДОЛЖНО сопровождаться переходами электронов по энергетическим уровням. Здесь какие-то вопросы есть? Вы можете предложить другие механизмы приращения энергии излучения?? Цитата И что неупругими ударами определяется только излучение, но не температура - одна из мер этой энергии, численное значение которой отличается от численного же значения энергии только размерным коэффициентом. И что температура вместе с неупругими ударами является причиной теплового излучения, но не наоборот. Кажется странным утверждение, что температура определяется интенсивностью только неупругих ударов атомов. В адиабатических процессах, при стремлении давления к 0 сопровождается стремлением температуры тоже к 0 при любой молярной энергии идеальных газов (средней энергии электронов на возбужденных энергетических уровнях). Именно этот показатель и свидетельствует, что электроны на возбужденных энергетических уровнях, без неупругих ударов, могут находиться неопределенно долгое время. Это подтверждается тем, что увеличение давления сопровождается увеличением интенсивности теплового излучения, соответственно и температуры. Цитата Странными кажутся и две первые формулы из трех, противоречащие друг другу. если Вашу первую формулу V=Q/P подставить в третью RT=VP, то RT=VP=(Q/P)P=Q, что не совпадает ни с тем, чему учили меня и, подозреваю, Вас тоже, ни с Вашей второй формулой kQγ=PVγ=QVγ-1, откуда Q=V/k1/(γ-1). Не исключено, конечно, что в каком-то частном случае можно подобрать параметры конкретной порции газа так, чтобы Q=V/k1/(γ-1), Вы правы. Я допустил неточность и в первой формуле не указал условие: V∝Q/P, при P=const kQγ=PVγ, RT=VP. Теперь ВСЕ сходится?? Кстати, если первую формулу V∝Q/P подставить в третью RT=VP, то RT=VP∝(Q/P)P∝Q, то есть RT∝Q, что полностью соответствует изобарным и изохорным процессам. Где Вы видите несоответствия с изобарными и изохорными процессами?? Изотермические и изобарные процессы свидетельствуют, что молярная тепловая энергия и давление являются первичными фактороми, а молярный объем и температура вторичными. ========== Цитата Другое дело, что иногда по излучению можно определить температуру и наоборот. Но далеко не всегда, так как для этого надо знать еще много чего, меняющегося от случая к случаю. Например, в экране и индикаторных светодиодах Вашего компьютера и телевизора, в любых лазерах, включая все газовые, или в обычных бытовых люминесцентных лампах и просто в цветных газах. Вы правильно уточнили -- иногда и меняющегося от случая к случаю. 1. Кроме излучений неупругих ударов есть и вынужденные излучения, которые тоже участвуют в образовании температур (например, лазерами режут материалы). 2. В изотермической системе из двух камер с разными давлениями, в разных камерах, в результате разных средних энергий электронов на возбужденных энергетических уровнях и разной интенсивности неупругих ударов между атомами, максимальные интенсивности общих спектров будут разные. Следовательно, по общим спектрам нельзя определить температуру газов. ВЫВОД: по спектрам Планка нельзя определять температуру газовых сред. Механизмы формирования общих спектров лучше рассматривать в специальной теме: http://wasp.phys.msu.ru/forum/index.php?showtopic=18532 Сообщение отредактировал Карандаш - 13.4.2012, 10:49 -------------------- Решать проблемы проще ВМЕСТЕ :drinks:
"Трехмерная гидродинамика и перенос тепла излучением - вот те проблемы, которые должны быть решены для того, чтобы изучать в деталях образование галактик и звезд." //[i] Я. Б. Зельдович С уважением, Карандаш |
 30.9.2011, 13:00 30.9.2011, 13:00
Сообщение
#16
|
|
|
как взрослый Группа: Легенды Сообщений: 7,967 Репутация: 371 Предупреждения: (0%) 
|
Да, я претендую на написание уравнений для всех равновесных состояний идеальных газов.
... Пример. В реактивном двигателе потоки атомов и молекул имеют огромную кинетическую скорость. Но, как только они теряют давление, то и температура прямо пропорционально падает. Сами себе противоречите, состояние газа в двигателе и при выходе в атмосферу не является равновесным. |
 30.9.2011, 13:42 30.9.2011, 13:42
Сообщение
#17
|
|
|
уважаемый       Группа: Альтернативщики Сообщений: 146 Репутация: -8 Предупреждения: (0%) 
|
Да, я претендую на написание уравнений для всех равновесных состояний идеальных газов. ... Пример. В реактивном двигателе потоки атомов и молекул имеют огромную кинетическую скорость. Но, как только они теряют давление, то и температура прямо пропорционально падает. Сами себе противоречите, состояние газа в двигателе и при выходе в атмосферу не является равновесным. Не вижу противоречий. Разбейте газ на отдельные равновесные участки, например состояния газов в самом двигателе это один участок, а состояния газов на расстоянии 20 м от двигателя это второй участок.  Можно рассмотреть другой вариант: высокие скорости газов в аэродинамической трубе сами по себе температуру не создают. Сообщение отредактировал Карандаш - 30.9.2011, 13:54 -------------------- Решать проблемы проще ВМЕСТЕ :drinks:
"Трехмерная гидродинамика и перенос тепла излучением - вот те проблемы, которые должны быть решены для того, чтобы изучать в деталях образование галактик и звезд." //[i] Я. Б. Зельдович С уважением, Карандаш |
 30.9.2011, 16:05 30.9.2011, 16:05
Сообщение
#18
|
|
|
супер-элита          Группа: VIP Сообщений: 811 Репутация: 11 Предупреждения: (0%) 
|
Кстати, если первую формулу V∝Q/P подставить в третью RT=VP, то RT=VP∝(Q/P)P∝Q, то есть RT∝Q, что полностью соответствует изобарным и изохорным процессам. Где Вы видите несоответствия с изобарными и изохорными процессами?? То есть, "теплоемкость" газа одинакова в обоих процессах?
Сообщение отредактировал АИД - 30.9.2011, 16:06 -------------------- С уважением,
АИД |
 30.9.2011, 23:00 30.9.2011, 23:00
Сообщение
#19
|
|
|
уважаемый       Группа: Альтернативщики Сообщений: 146 Репутация: -8 Предупреждения: (0%) 
|
Цитата(Карандаш @ 30.09.2011, 11:40) * Кстати, если первую формулу V∝Q/P подставить в третью RT=VP, то RT=VP∝(Q/P)P∝Q, то есть RT∝Q, что полностью соответствует изобарным и изохорным процессам. Где Вы видите несоответствия с изобарными и изохорными процессами?? То есть, "теплоемкость" газа одинакова в обоих процессах? Вы правильно подметили. Спасибо. Я упустил, что в первой формуле, по условию ограничено изменение давления и ее нельзя подставлять в RT=VP, если подставлять, то подставлять нужно из формулы kQγ=PVγ, в результате получим: зависимость между температурой, молярным объемом и молярной тепловой энергией: RT=kQγV(1-γ), (2) зависимость между температурой, давлением и молярной тепловой энергией: Rγ Tγ=kQγ P(γ-1), (3) Как видно из этих формул, изменение температуры в изобарном и изохорном процессах требуют различной молярной тепловой энергии, следовательно, и теплоемкости для изохорных и изобарных процессах разные. Сообщение отредактировал Карандаш - 23.10.2011, 17:18 -------------------- Решать проблемы проще ВМЕСТЕ :drinks:
"Трехмерная гидродинамика и перенос тепла излучением - вот те проблемы, которые должны быть решены для того, чтобы изучать в деталях образование галактик и звезд." //[i] Я. Б. Зельдович С уважением, Карандаш |
 3.10.2011, 14:47 3.10.2011, 14:47
Сообщение
#20
|
|
|
уважаемый       Группа: Альтернативщики Сообщений: 146 Репутация: -8 Предупреждения: (0%) 
|
у меня размерности почему-то упорно сходятся только при γ=1 и дальше все становится непонятным. Буду весьма признателен. Помню со школы. Формула для теплоемкости 1-го моля газа γ= i/2, где i - количество степеней свободы, равное 3 для одноатомных газов, 5 для двухатомных, 7 для трехатомных и т.д. Для 1-й молекулы R заменяется на постоянную Больцмана k, меньшую в число Авогадро раз. Уточнения от Вас я так и не дождался. Думаю, что Вы имели в виду эти зависимости U=i/2PV=i/2RT. Дело в том, что число степеней свободы молекулы, проявляющееся в теплоемкости, НЕ ПОСТОЯННЫ и изменяются при изменении температуры. Например молекула водорода, при разных температурах, изменяет коэффициенты пропорциональности, которые могут соответствовать числу степеней свободы от 3 до 7. (Савельев, т.3. Внутренняя энергия и теплоемкость идеального газа. стр. 345) Объяснение такого поведения дается квантовой механикой и требует отдельного анализа. Для ответа о соответствии моих формул с реальностью нужны лабораторные эксперименты, в которых нужно сопоставить U=i/2PV и kQγ=PVγ при разных температурах, но у меня нет такой возможности. Могу только предположить, что мое уравнение kQγ=PVγ может оказаться более соответствующим реальности, чем U=i/2PV=i/2RT. Я надеюсь, что ответил на Ваши вопросы. -------------------- Решать проблемы проще ВМЕСТЕ :drinks:
"Трехмерная гидродинамика и перенос тепла излучением - вот те проблемы, которые должны быть решены для того, чтобы изучать в деталях образование галактик и звезд." //[i] Я. Б. Зельдович С уважением, Карандаш |
  |
1 чел. читают эту тему (гостей: 1, скрытых пользователей: 0)
Пользователей: 0
| Текстовая версия | Сейчас: 10.04.2016, 4:37 |















