|
Ныс П.С., Курочкина В.Б., Скляренко А.В., Вейнберг Г.А. Государственный научный центр по антибиотикам, Москва, Россия, Латвийский институт органического синтеза, Рига,
Латвия
В начало...
Более половины всех используемых в настоящее время в мире антибиотиков составляют беталактамы. Основным фактором, ограничивающим клиническую эффективность беталактамных антибиотиков, является эволюция микроорганизмов, сопровождающаяся возникновением устойчивости к действию антибиотиков. Этот биологический феномен - антибиотикорезистентность - определяет как тактику терапии и направления деятельности фармацевтической промышленности, вынужденной производить все новые антибактериальные препараты, так и направления научных исследований по поиску новых эффективных препаратов. Широкое применение цефалоспоринов II-III поколения - препаратов с широким спектром действия и высоким уровнем активности в отношении грамотрицательной микрофлоры, в последнее время вызвало сдвиг в этиологии инфекционных заболеваний в сторону грамположительной микрофлоры (энтерококков и метициллинорезистентных стафилококков) с множественными механизмами природной или приобретенной устойчивости. Соответственно основным направлением должен быть поиск новых беталактамных структур, обладающих активностью в отношении перечисленных микроорганизмов. Такой поиск может быть осуществлен путем направленной модификации беталактамов, связанной с введением заместителей, изменяющих определенные свойства природного или синтетического аналога.
Для определения перспективных направлений модификации беталактамов и прогнозирования активности новых соединений необходимо установление взаимосвязи структуры и биологических свойств беталактамных антибиотиков на основе знания механизмов их действия и механизмов резистентности микроорганизмов.
Прошло уже почти 70 лет с тех пор, как Александр Флеминг обнаружил антибиоз между плесневым грибом Penicillium и бактериальными культурами и назвал действующее начало пенициллином. Выдвинутое Абрахамом в 1943 году предположение о том, что пенициллин содержит беталактамное кольцо, было в 1949 году подтверждено Крофутом с помощью кристаллографических исследований.
Пенициллин - первый природный антибиотик, который был изучен и использован в клинической медицине. Сейчас его можно рассматривать как родоначальника семейства беталактамных антибиотиков (беталактамов), характеризующихся наличием в их структуре четырехчленного беталактамного кольца. Сначала пенициллины были обнаружены в грибах, а позже (в 1962 году) также и в стрептомицетах. Цефалоспорины, второй член семейства беталактамных антибиотиков, тоже сначала были обнаружены в грибах (1955 год), а затем в стрептомицетах (1974 год).
До 1970 года пенициллины и цефалоспорины были единственными примерами природных беталактамных антибиотиков. Открытие в 1971 году 7-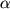 -метоксицефалоспоринов из Streptomyces стимулировало поиск новых производимых микроорганизмами беталактамных антибиотиков. В настоящее время известные беталактамные антибиотики в соответствии с их структурой классифицируют следующим образом (таблица, рис. 1) [1-3]. -метоксицефалоспоринов из Streptomyces стимулировало поиск новых производимых микроорганизмами беталактамных антибиотиков. В настоящее время известные беталактамные антибиотики в соответствии с их структурой классифицируют следующим образом (таблица, рис. 1) [1-3].
| Таблица. Основные группы беталактамных антибиотиков |
| Группа |
Особенности структуры ядра беталактама |
Обозначение на рис. 1 |
| Пенициллины (пенамы) |
Сопряженная беталактам-тиазолидиновая система колец |
1 |
| Цефалоспорины (цефемы) |
Сопряженная беталактам-дигидротиазиновая система колец |
2 |
| Цефамицины |
Сопряженная беталактам-дигидротиазиновая система колец, содержащая 7-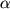 -метоксигруппу -метоксигруппу |
3 |
| Оксацефемы |
Сопряженная беталактам-дигидрооксазиновая система колец |
4 |
| Пенемы |
Сопряженная беталактам-дигидротиазоновая система колец |
5 |
| Kлавуланаты (Kлавулановая кислота) |
Сопряженная беталактам-оксазолидиновая система колец |
6 |
| Kарбапенемы (тиенамицин) |
Сопряженная беталактам-дигидропирроловая система колец |
7 |
| Нокардицины |
Моноциклические беталактамы |
8 |
| Монобактамы |
Моноциклические беталактамы сульфаминовой кислоты |
9 |
 |
Рис. 1. Основные группы беталактамных антибиотиков. |
 |
Рис. 2. Хронология открытия основных беталактамных антибиотиков. |
 |
Рис. 3. Гетероциклические скелеты беталактамных антибиотиков. |
Хронология открытия этих антибиотиков наглядно показана на рис. 2, а на рис. 3 даны тривиальные названия входящих в их структуру колец [3-6]. Традиционно при описании беталактамных антибиотиков в качестве положсния 1 выбирается атом серы в кольце, как это показано в соответствующих структурах на рис. 1. Заместители в этих бициклических системах чаще описываются с использованием префиксов 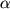 - или - или 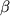 -, а не эквивалентных им exo или endo. -, а не эквивалентных им exo или endo.
К настоящему времени беталактамы найдены в грибах, актиномицетах (в основном из рода Streptomyces) и даже в бактериях.
Механизм действия беталактамных антибиотиков. Проблема резистентности микроорганизмов
Определяющая роль беталактамного кольца в биологической активности беталактамных антибиотиков была установлена еще в 40-е годы. Любые превращения, приводящие к его расщеплению, сопровождаются полной утратой биологической активности соединения. Объяснение этого кроется в механизме действия беталактамных антибиотиков [6-11].
Беталактамные антибиотики - полярные гидрофильные соединения, проникающие в клетки бактерий через пориновые каналы внешней мембраны (рис. 4) [6]. Связывание беталактамных антибиотиков с так называемыми пенициллинсвязывающими белками (ПСБ) - ферментами транс- и карбоксипептидазами, участвующими в образовании пептидогликановых цепей внутренней мембраны бактериальной клетки, приводит к прекращению деления, а затем и к гибели клетки. Связывание антибиотика с ПСБ происходит благодаря сродству беталактамной структуры к структуре активного центра ПСБ. В процессе связывания карбонильный углерод беталактама нуклеофильно атакуется группами активного центра ПСБ, и кольцо раскрывается. Всвязи с этим для проявления антибактериальной активности антибиотика необходима интактность его беталактамного кольца, однако ациламидная связь в беталактаме должна быть достаточно лабильной для разрыва в процессе связывания.
 |
Рис. 4. Взаимодействие беталактамного антибиотика и мишени в клетках грамотрицательных бактерий. |
Интересно, что к числу количественных характеристик, хорошо коррелирующих с биологическими свойствами, относится константа скорости основного гидролиза беталактамного антибиотика при рН?9,6-10,0. Этот процесс моделирует нуклеофильную атаку беталактамного карбонила в биологической среде. Чем выше скорость гидролиза, тем больше антибактериальная активность соответствующего соединения. Так, для активных соединений период полураспада в реакции основного гидролиза составляет 3-20 ч, а для неактивных - более 70 ч [3]. Расчеты, проведенные по данным работы [12], показывают, что период полураспада беталактамного кольца цефалоспоринов IV поколения, составляет 1-10 ч.
Эволюция бактерий, приводящая к возникновению у них резистентности к беталактамным антибиотикам, происходит по следующим направлениям [7, 8, 10, 11, 13-15]:
- снижение проницаемости внешней мембраны (потеря поринов);
- изменение структуры ПСБ;
- активный транспорт антибиотика из клетки (выброс антибиотика);
- синтез бета-лактамаз - ферментов, разрушающих антибиотики (индукция хромосомальных бета-лактамаз и их гиперпродукция; синтез плазмидных бета-лактамаз широкого спектра действия, инактивирующих антибиотик на пути к внутренней мембране - месту локализации ПСБ) (см. рис. 4).
Бета-лактамазный механизм резистентности микроорганизмов является, безусловно, наиболее действенным и распространенным. Резистентность бактерий к пенициллинам, связанная с разрушением последних бета-лактамазами, была обнаружена уже в конце 40-х годов и ознаменовала возникновение, так называемой <пенициллиновой проблемы>. Тогда же был намечен основной путь решения <пенициллиновой проблемы> - изменение структуры ацильного радикала в молекуле пенициллина. Дело в том, что структура боковой цепи играет определяющую роль в проникновении антибиотика через внешнюю мембрану и в ингибировании бета-лактамазами. Поначалу казалось, что, изменяя структуру ацильного радикала пенициллина путем введения в культуральную жидкость гриба соответствующего предшественника, используемого продуцентом для построения боковой цепи антибиотика, удастся решить проблему борьбы с антибиотикорезистентностью возбудителей заболеваний. Так, введением в культуральную жидкость Penicillium сhrysogenum в качестве предшественника феноксиметилуксусной кислоты был впервые проведен направленный биосинтез антибиотика феноксиметилпенициллина. Однако потенциал биосинтетического пути решения <пенициллиновой проблемы> оказался ограниченным, а сам путь тупиковым.
Реальная возможность получения широкого многообразия пенициллинов появилась в начале 60-х годов, когда было обнаружено <ядро> пенициллинов - 6-аминопенициллановая кислота (6-АПК) (10) и предложены промышленные методы ее получения ферментативным гидролизом бензилпенициллина. В конце 60-х годов были разработаны промышленные методы получения <ядра> цефалоспоринов - 7-аминоцефалоспорановой кислоты (7-АЦК) (11) путем химического гидролиза биосинтетического цефалоспорина С [16]. 6-АПК и 7-АЦК являются ключевыми соединениями для получения всего многообразия полусинтетических пенициллинов и цефалоспоринов. Их химическое или ферментативное ацилирование позволяет вводить различные заместители в С(6) или С(7) положения молекул пенама или  3-цефема соответственно. Это является наиболее радикальным способом изменения и расширения антибактериального спектра действия пенициллинов и цефалоспоринов. 3-цефема соответственно. Это является наиболее радикальным способом изменения и расширения антибактериального спектра действия пенициллинов и цефалоспоринов.
 |
 |
Таким же образом через модификацию соответствующих ключевых соединений была решена задача получения других типов беталактамных антибиотиков, в соответствии с хронологией, представленной на рис. 2.
В отличие от пенициллинов, цефалоспоринов и монобактамов, получаемых ацилированием ключевых соединений - аминокислот, для получения пенемов и карбапенемов, помимо традиционного пути, основанного на модификации природного тиенамицина, в настоящее время предложен эффективный метод химического синтеза, где в качестве ключевого соединения используется азетидинон Kaneka (12) - (3R,4R)-4-ацетокси-3-[(R)-(третбутилдиметилсилилокси)этил]-2-азетидинон:
Далее...
Написать комментарий
|

