|
Н.В. Пивень1, В.В. Новиков2, Л.Н. Лухверчик3, Е.И. Кузьменкова4 1Институт биоорганической химии НАН Б,
2Нижегородский государственный университет им .Н.И.Лобачевского, Россия
3Международный экологический университет им.А.Д.Сахарова,
4Республиканский консультативный эндокринологический центр МЗ РБ, Минск, Беларусь
Иммунопатология, аллергология, инфектология N3-2001, с.15-20.
В начало...
(Окончание)
Результаты иммуноферментного анализа концентрации Fas-рецептора в сыворотке крови представлены в таблице 2.
| Таблица 2. Концентрация FasR в сыворотке крови лиц с различными формами патологии ЩЖ (M m) |
| Обследуемые группы |
Количество CD95 в У.Е |
| Здоровые лица, (n=11) |
356,9 47,69 |
| Субклинический гипотиреоз (n=32) |
1035,69 202,6* |
| АИТ с клинически выраженным гипотиреозом (n=20) |
763,6 46,18* |
| Рак ЩЖ (n=9) |
106 4,79* |
Как видно из таблицы, в группе обследуемых с субклиническим гипотиреозом отмечалось повышение уровня Fas-R в 2,9 раза, а у лиц с клинически выраженным гипотиреозом - в 2 раза по сравнению с контрольной группой. Уровень FasR у лиц с онкопатологией ЩЖ был снижен в 3 раза по сравнению с контрольной группой.
Известно, что у нормально функционирующих тироцитов экспрессия FasR на их мембране незначительна на фоне активной экспрессии FasL [14]. Вероятно, такой механизм защищает ЩЖ от воздействия клеток собственной иммунной системы [15]. Однако при развитии аутоиммунных процессов, сопровождающихся воспалением, макрофаги и моноциты периферической крови начинают синтезировать ИЛ-1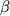 , который стимулирует массивную экспрессию FasR на мембране тироцитов. В результате одновременной активной экспрессии FasR и FasL в тироцитах запускается программа апоптоза [16,17]. Кроме того, повышенная экспрессия FasR на тироцитах делает их доступными для цитотоксических CD8+- Т-лимфоцитов[18], которые в результате их активации экспрессируют FasL. Можно предположить, что эти процессы усугубляют повреждение тироцитов и способствуют развитию аутоиммунной патологии. Описанный механизм схематично изображен на рис.2. , который стимулирует массивную экспрессию FasR на мембране тироцитов. В результате одновременной активной экспрессии FasR и FasL в тироцитах запускается программа апоптоза [16,17]. Кроме того, повышенная экспрессия FasR на тироцитах делает их доступными для цитотоксических CD8+- Т-лимфоцитов[18], которые в результате их активации экспрессируют FasL. Можно предположить, что эти процессы усугубляют повреждение тироцитов и способствуют развитию аутоиммунной патологии. Описанный механизм схематично изображен на рис.2.
 |
| Рисунок 2. Схема развития апоптоза в тироцитах при аутоиммунной патологии |
Обнаруженное нами снижение Fas-R у онкологических больных, вероятно, можно связать с подавлением экспрессии и блокадой Fas-R стимуляторами опухолевого роста, которые защищают опухолевые клетки от развития в них процессов апоптоза [19-21]. Кроме того, опухолевые клетки сами секретируют растворимые супрессорные факторы, угнетающие развитие апоптоза через механизм FasR-FasL. Все это приводит к блокаде механизмов апоптоза, следствием которой является бесконтрольная пролиферация опухолевых клеток и проявление несостоятельности противоопухолевого иммунитета.
Выявленные нами нарушения регуляторных механизмов апоптоза сопровождаются различными изменениями концентрации FasR в крови. Концентрация FasR повышается при гипотиреозе, причем степень этого повышения зависит от стадии гипотиреоза: если при субклиническом гипотиреозе экспрессия FasR достаточно высока, то при клинически выраженном его концентрация снижается, однако, остается существенно выше, чем у здоровых лиц.
В то же время у больных раком ЩЖ уровень FasR в крови значительно снижен по сравнению с контролем. Все это позволяет говорить о взаимосвязи характера патологических нарушений с функционированием системы FasR-FasL.
Таким образом, можно заключить, что подавление иммунологического надзора и нарушение регуляции механизмов апоптоза может являться одним из патогенетических механизмов развития заболеваний ЩЖ, а концентрация FasR (CD95) в крови - количественным маркером этих нарушений и прогностическим критерием развития той или иной формы патологии.
1. Abastado J.-P. Apoptosis: function and regulation of cell death. Res Immunol 1996; 147:443-56. 2. Adrens M.J., Wylle A.H. Apoptosis. Mechanism and role in patology. Intern. Rev. Exp.Pathol. 1991; 32: 223-54. 3. Adachi M., Suematsu S., KondoT. Targeted mutation in the Fas gene causes hyperplasia in peripheral lymphoid organs and liver. Nat. Med.1995; 11:294-99. 4. Peng S.L., Robert M.E., Hayday A.C., Craft J. . A tumor-suppressor function for Fas (CD95) revealed in T cell-deficient micе. J Exp. Med. 1996; 84: 1149-54. 5. Аббасова С.Г., Липкин В.М., Трапезников Н.Н., Кушлинский Н.Е. Система Fas-FasL в норме и при патологии Вопросы биол.мед. и фарм. химии 1999; 3:3-16. 6. French L.E., Tschopp J. Thyroiditis and hepatitis: Fas on the road to disease. Nat Med. 1997; 4:387-88. 7. French L.E., Hahne M., Viard I. Fas and Fas ligand in embryos and adult mice: ligand expression in several immune-privileged tissues and coexpression in adult tissues characterized by apoptotic cell turnover. Cell Biol 1996; 133:335-43. 8. Новиков В.С. Программированная клеточная гибель. Санкт-Петербург: Наука; 1996. 9. Baryshnikov A.Yu., Polosukhina E.R., Zabotina T.N., Lazareva N.I., Lukashina M.I., Shishkin Yu.V. et al Fas (APO-1/CD95) Antigen: New Activation Marker for Evalution of the Immune Status Rus. J of Immunology 1997; 2: 116-19. 10. Bufler P., Stiegler G., Schuchmann M., Hess S., Kruger C. et al. Soluble lipopolysacharide receptor (CD14) is released via two different mechanisms from human monocytes and CD14 transfectants. J Immunol. 1995; 25:604-610. 11 . Weetman A.P., McGregor A.M. Antigen presentation in the pathogenesis of autoimmune endocrine disease. J Autoimmun. 1995; 3:305-12. 12. Krumskemper H.L. Rationaldiagnosis of thyroid disease. Vienna 1977;143-52. 13. Falk S.A. Thyroid Disorders. New York 1997; 17-20. 14. De Maria R., Testi R. Fas-FasL interactions: a common pathogenetic mechanism in organ-specific autoimmunity. Immunology Today 1998; 19:121-25. 15. De Flora A., Franco L., Guida L., Bruzzone S., Zocchi E. Ectocellular CD38-catalyzed synthesis and intracellular Ca(2+)-mobilizing activity of cyclic ADP-ribose. Cell Biochem Biophys 1998;28:45-62. 16. Dayan C.M., Danirls G.H. Chronic autoimmune thyroiditis.N Engl J Med 1996; 335:99-107. 17. Champion B.R., Cooke A., Rayner D.C. Thyroid autoimmunity. Curr Opin Immunol. 1992; 6:770-78. 18. Giordano C., Stassi G., De Maria R. . Potential involvement of Fas and its ligand in the pathogenesis of Hashimoto's thyroiditis. Science. 1997; 275:960-3. 19. Benoist C., Mathis D. Cell death mediators in autoimmune diabetes-no shortage of suspects. Cell. 1997; 89:1-3. 20. Wright S.C., Zhong J., Larrick J.W. Inhibition of apoptosis a mechanism of tumor promotion. FASEB J. 1994;8:654-60. 21. Барышников А.Ю., Шелепов В.П., Кузнецов С.В., Шишкин Ю.В., Седяхина Н.П., Донская О.Н. Экспрессия и проявление функциональной активности Fas/APO-1/CD95-антигена, опосредующего апоптоз, при гемобластозах у человека. Гематол. и трансфузиол. 1996; 5:42-44.
Написать комментарий
| 
