|
В гидрометаллургических процессах извлечение металлов
из руд, концентратов, производственных полупродуктов и их отходов производится
путем их обработки водными растворами химических реагентов с последующим
выделением из раствора металла или его химического соединения. Их применение
обеспечивает избирательное извлечение металлов из бедных и труднообогатимых
руд с минимальными затратами реагентов в простой аппаратуре при низких
температурах (извлечение золота в цианистые растворы, урана - в сернокислые
или содовые, меди - в сернокислые растворы). В некоторых случаях возможно
непосредственное извлечение металлов в раствор из рудного тела (подземное
выщелачивание меди и урана из руд). Обеспечивается комплексная переработка
сырья с высоким извлечением всех ценных составляющих. Например, осуществляется
попутное извлечение кадмия, индия, таллия при производстве цинка, галлия
- при производстве глинозема, молибдена - при переработке вольфрамовых
концентратов. Замена гидрометаллургическими более традиционных пирометаллургических
процессов резко сокращает загрязнение атмосферы вредными выбросами.
Имеется большое сходство теоретического описания
гидрометаллургических процессов и процессов гидротермального
рудообразования, так как обе теории базируются на термодинамике и
кинетике химических процессов. Реакции, которые осуществляются на разных
стадиях - общие как для гидрометаллургических процессов, так и для рудообразования,
в основе которых лежат химические взаимодействия. Теория тех и других
включает рассмотрение следующих двух аспектов: (1) определения термодинамических
характеристик процесса, а по ним - физико-химических условий (температуры,
давления и концентрации реагентов в растворах), при которых возможно его
осуществление; (2) раскрытие кинетических особенностей процесса,
позволяющих оценить его скорость, механизмы и промежуточные стадии его
протекания. Кроме того, аналогичными являются и объекты исследования,
в обоих случаях это рудные минералы.
Однако цели исследований для этих двух
направлений разные: если экспериментальная минералогия стремится раскрыть
сущность рудоотложения (источник рудного вещества, механизм его
концентрирования в природе, растворимость и формы переноса элементов в
гидротермальных растворах и условия их отложения), то задача гидрометаллургии
в какой-то мере обратная: разложить (растворить, перевести в другую
форму) природные рудные минералы и выделить из них чистый металл. Так
или иначе для обеих областей необходимы знания одних и тех же химических
и термодинамических свойств элементов и минералов в условиях повышенных
температур и давлений. Поэтому оба направления способны взаимно обогащать
друг друга. Знание процессов природного рудообразования (условий существования
типичных парагенезисов, стадий рудоотложения, характерных элементов примесей
в рудных минералах и т.д.) помогает комплексному использованию руд, способно
предложить подходы к улучшению и даже созданию новых технологических
схем гидрометаллургических процессов. Имеются в виду работы по изучению
устойчивости рудных минералов (сульфидов, оксидов, вольфраматов, силикатов
и др.) в различных средах, получение термодинамических характеристик соответствующих
реакций, данных по растворимости и формам существования (переноса) рудных
элементов, оценке кинетических констант растворения рудных минералов в
высокотемпературных условиях, изучению коэффициентов
распределения рудных компонентов между минералом и раствором, а также
редких элементов и изотопов
между самими рудными минералами, исследование ионообменных свойств и экстрагирующей
способности солевых расплавов и растворов в отношении рудных элементов.
Наоборот, равновесия, осуществляемые в гидрометаллургических схемах, являются
составными частями моделей переноса рудного вещества
и формирования рудных залежей.
Определенное сходство гидрометаллургические процессы
имеют с экспериментальным моделированием гидротермальных процессов также
по применяемой в обоих случаях автоклавной аппаратуре.
Усложнение конструкции окупается большим выигрышем в скорости процесса
на стадии выщелачивания благодаря повышению температуры.
Так, при разложении шеелита раствором соды увеличение
температуры от 225 до 3000 позволяет
сократить продолжительность выщелачивания от 2 часов до 5 -10 минут.
Общими
в технологических схемах гидрометаллургии являются следующие стадии:
измельчение рудного материала, его обогащение и перевод малорастворимых
соединений в растворимые - разложение или вскрытие рудного материала;
выщелачивание - перевод металла из рудного материала в водный
раствор;
разделение твердой и жидкой фаз;
подготовка растворов к выделению из них чистых соединений
или металлов: очистка растворов от примесей; концентрирование раствора;
выделение из растворов чистых соединений или металлов.
Рассмотрим некоторые примеры экспериментальных минералогических и
петрологических исследований, нашедших применение в гидрометаллургии.
Технология переработки минерального сырья и, в
частности, процессы выделения из руд минералов тесно взаимосвязаны с комплексом
геолого-минералогических исследований, что в последние годы нередко обозначают
термином минералургия. Минералого-технологические исследования шеелит-повеллитовых
руд Тырныаузского месторождения (Северный
Кавказ) позволили выделить на месторождении четыре структурно-химических
типа шеелита в зависимости от содержания и формы вхождения молибдена
в структуру минерала. Для природных фаз была доказана ограниченность изоморфизма
в ряду шеелит-повеллит, подтвержденная позднее экспериментальными исследованиями,
в которых была установлена область несмесимости в этом твердом растворе
в интервале температур 300-5000С.
Было показано, что флотируемость шеелита и молибдошеелита
связаны с содержанием в минералах повеллитовой составляющей CaMoO4,
наличием в них дефектов кристаллической структуры и структур распада твердого
раствора. Поэтому даже небольшое изменение состава молибдошеелита в рудах
резко меняет выход концентрата этого минерала при обогащении. Кроме того,
было обнаружено, что на флотационную активность
шеелита и его аналогов влияют концентрации различных типов дефектов (анионные
и кислородные вакансии и элементы-примеси), отражающиеся в спектрах
люминесценции. В процессе флотационного обогащения
упомянутые дефекты вследствие взаимодействия с различными водными растворами
претерпевают ряд превращений, результатом чего является снижение концентрации
поверхностных анионных вакансий и соответствующее снижение флотационной
активности поверхности минеральных зерен шеелита и молибдошеелита. Поэтому
для предотвращения разрушения центров адсорбции и сохранения флотационной
активности шеелита и его аналогов в технологическом процессе отмывку жидкого
стекла с поверхности этих минералов следует вести в присутствии восстановителей
или при насыщении пульпы водородом. Был предложен метод предварительной
термообработки (спекания) при температурах до 5600С,
которая сопровождалась изменением люминесцентных свойств и соответствующих
оптических центров, выступающих одновременно в роли центров адсорбции,
и приводила к более эффективному выделению из них концентрата. Для шеелита
извлечение увеличилось с 10 до 53%, для молибдошеелита - с 24 до 74%.
Изучение свойств кислот
(Н2СО3,
H2S и др.), щелочей, а также солей рудных
металлов при высоких параметрах, требующее гидротермальной аппаратуры,
почти не проводится химиками и практически монополизировано специалистами
в области экспериментального моделирования гидротермального
рудообразования. Данные по константам диссоциации и растворимости
этих соединений в воде, их способности к комплексообразованию необходимо
знать для выбора оптимальных условий протекания процессов на стадиях выщелачивания,
очистки растворов от примесей и выделения металлов или их солей из водных
растворов. Разработанные основы моделей рудообразования на гидротермальных
месторождениях, включающие представления о температуре, давлении, кислотно-щелочной
эволюции растворов, приводящей к отложению рудных парагенезисов, данные
о режиме сульфидной серы, о наиболее вероятных концентрациях рудообразующих
растворов и формах переноса элементов, служат базой
для технологических процессов в гидрометаллургии.
Например, данные по условиям устойчивости и разложения
халькопирита и пентландита
в условиях закрытой системы, привели к обоснованию новых методов автоклавной
переработки (первая стадия гидрометаллургической схемы) пирротиновых
и медных концентратов Норильского комбината и Удоканского
месторождения.
Существовавшая с 1979 г. на Надеждинском заводе Норильского горно-металлургического
комбината технология переработки пирротиновых концентратов представляла
собой гидрометаллургическую схему обогащения с использованием в качестве
главной операции автоклавно-окислительного выщелачивания их водной пульпы
при повышенной температуре и избыточном давлении кислорода. При разложении
пирротинового концентрата около 80% сульфидной серы окисляется до элементарной,
а остальная ее часть - до сульфатной . Процесс выщелачивания пирротина
можно записать в виде суммарной реакции:
Fe7S8 (тв) + 6,5O2
 3Fe2O3
(тв) + 7S (эл) + FeSO4 3Fe2O3
(тв) + 7S (эл) + FeSO4
Oбратный процесс осаждения цветных металлов происходит в восстановительной
среде, создаваемой добавками металлического железа, по суммарной реакции:
MeSO4 + Fe (мет) + S
(эл)  MeS
(тв) + FeSO4 , где Me
- это Ni, Co, Cu. MeS
(тв) + FeSO4 , где Me
- это Ni, Co, Cu.
В качестве железосодержащего реагента применялись металлизованные
окатыши с содержанием металлического железа 50 - 85%, а процесс вели при
температуре 900 С.
Для отделения сульфидов цветных металлов от оксидов железа
и пустой породы использован процесс флотации, основанный
на различной смачиваемости водой поверхности минералов.
Серосульфидный концентрат подвергался дезынтеграции
серы и сульфидов (гидролизу), которая достигался
обработкой продукта сернистым натрием при 120 - 1300.
Последующее разделение серы и сульфидов осуществляется серной флотацией
с получением серного концентрата, содержащего свыше 70% элементарной серы.
Сульфидный концентрат с содержанием до 5% элементарной серы, перерабатывается
затем в печах взвешенной плавки.
Таким образом, сера, являясь товарным продуктом данной технологии, одновременно
служит и реагентом сульфидизатором цветных металлов на стадии их осаждения
из окисленных пульп пирротинового концентрата.
Для выявления оптимальных физико-химических параметров сульфидирования
цветных металлов в водных растворах специалистами в области экспериментальной
минералогии были проведены исследования по взаимодействию серы с водой
и водными растворами в присутствии нейтрализаторов и щелочей.
Было известно, что при обычных и повышенных (> 1000С)
температурах в окислительной обстановке стабильными являются серная кислота
и продукты ее диссоциации, а в восстановительных - сероводородная кислота
и ее диссоциаты. Область устойчивости элементарной серы находится в кислых
растворах и приурочена к условиям сосуществования сульфатной и сульфидной
серы.
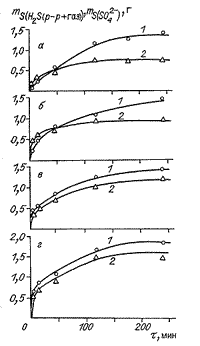 |
| Рис. 75. Кинетические кривые образования
сульфидной (1) и сульфатной (2) серы при взаимодействии воды с различными
количествами серы (в граммах: а - 4; б - 25; в - 40; г - 70) в автоклаве
при 2300 С (Экспериментальные данные Лаптева Ю.В. и др.). |
Равновесие серы с водой описывается реакцией 4S
(эл) + 4H2O
= 3H2S + H2SO4 . Исследовались
равновесные взаимоотношения растворенных форм серы (Н2S,
H2SO4 и др.) и кинетика процесса
при 150 - 3500 С и соответствующих
давлениях насыщенного пара. Методика исследований
включала две важные особенности: во-первых, производился отбор жидкой
и газовой фаз непосредственно при повышенной температуре во избежание
влияния охлаждения автоклава на конечный состав анализируемой системы
из-за обратимости реакций растворения; во-вторых, был применен спектрофотометрический
метод изучения состава растворов в ультрафиолетовой и видимой областях
длин волн при повышенных температурах с использованием специальных кювет.
Было показано, что основными компонентами раствора являются сероводород
и сульфат-ионы, а в газовой фазе обнаружен только сероводород. На рис.
75 приведены серии кинетических кривых по выходу серы в сероводородной
и сульфатной формах, которое происходит в соответствии с приведенной реакцией.
Они показывают, что выход серы в виде растворенных форм и их соотношения
во времени зависят от количеств элементарной серы в системе, и он увеличивается
при больших навесках серы и исходной загрузке. В течение первых 40 мин
выход "растворенной серы" быстро возрастает, но затем существенно замедляется.
Эти данные позволили получить зависимость скорости образования продуктов
реакции (растворенных форм серы, участвующих в процессе сульфидизации
металлов) от количества исходной серы, описывающейся линейным уравнением.
Определение выхода продуктов растворения серы в воде в весовых единицах
позволило быстро и просто оценивать такой важный технологический показатель
процесса, как степень расходования серы при ее заданном количестве, которая
зависит от конкретных соотношений исходной серы, водного раствора и газовой
фазы.
Разработанная методика регистрации спектров поглощения растворов
в ультрафиолетовой области при повышенных температурах позволяет фиксировать
присутствие в растворе таких форм серы, как акватированный SO2,
сульфит-, тиосульфат-ионы и др. С помощью этого метода получены свидетельства
образования молекулярной формы при взаимодействии элементарной серы с
водой S0 (р-р). Равновесная концентрация
молекулярной серы заметно возрастает при повышении температуры, достигая
при 250 - 3000 С приблизительно
50% от всех форм серы, находящихся в водном растворе. Эта форма серы служит
важным звеном в цепи реакций, приводящих к образованию сульфидов.
Данные по особенностям возникновения и существования
в водном растворе различных форм серы отражают лишь
одно сторону сложного процесса сульфидообразования (сульфидирования),
являющегося основной стадией в гидрометаллургической переработке сырья
цветных металлов. Другой важнейшей стороной является устойчивость самих
сульфидов в зависимости от основных физико-химических параметров - температуры,
кислотности-щелочности, окислительно-восстановительного
потенциала, в меньшей степени - давления. Решение этих теоретических
вопросов на основе как термодинамических расчетов, так и экспериментов,
позволило на количественном уровне прогнозировать результаты и гидротермальных
и гидрометаллургических процессов. Мерой степени прохождения реакций сульфидоосаждения
служит растворимость сульфидных фаз, которая определяет также конечное
содержание металлов в растворах и при сульфидировании оксидов.
Оказалось, что резко повышенной устойчивостью
(наименьшей растворимостью) обладают сульфиды меди Cu2S
и CuS. Растворимость дисульфидов Co,
Ni и Fe существенно
ниже растворимости моносульфидов, и даже в сильно кислых растворах при
значениях pH
от 0 до 1 она не превышает величин 10-4
моль/л. Это обеспечивает необходимую в технологическом отношении "глубину"
осаждения металлов во всем интервале pH,
которая соответствует конечной концентрации металла ~ 10-3
моль/л. Растворимости в ряду как дисульфидов, так и моносульфидов увеличиваются
в ряду - Ni < Co < Fe.
Необходимая "глубина" осаждения металлов, обусловленная стехиометрической
растворимостью, должна достигаться при следующих значениях pH:
| NiS |
CoS |
FeS |
| pH= 1,5 |
= 3 |
= 4,4 |
Таким образом, было показано, что в ряду моносульфидов
(в отсутствии дисульфидов) происходит селективное осаждение сначала меди
(в сильнокислых растворах), а затем никеля и кобальта и железа.
Необходимым условием для выполнения баланса окислительно-восстановительных
реакций служит присутствие молекулярной серы. Именно эта форма может
принимать участие в появлении одновалентной серы. Взаимодействие сера
- раствор обуславливают кинетические трудности для всего процесса образования
сульфидов. В присутствии элементарной серы, определяющей окислительно-восстановительное
состояние растворов, в них образуются дисульфиды, которые по сравнению
с моносульфидами обладают существенно меньшей растворимостью. Таким образом,
элементарная сера может быть использована в качестве сульфидизатора цветных
металлов во всем температурном интервале. В восстановительных условиях
(например, при действии на растворы сероводородом) одним из главных факторов
повышения степени осаждения цветных металлов в форме устойчивых в этом
случ |

