|
С. Р. Крапивнер, П. П. Малышев, А. Б. Полтараус, А. Н. Мешков, В. В. Кухарчук, В. Н. Бочков
Российский кардиологический научно-производственный комплекс Минздрава Российской Федерации,
Институт молекулярной биологии им. В.А. Энгельгардта РАН, Москва
При обследовании пациентов с клиническим диагнозом "семейная гиперхолестеринемия" (СГХС) методом анализа конформации одноцепочечной ДНК была обнаружена новая мутация (230insG) в гене рецептора липопротеидов низкой плотности. Анализ ДНК, проведенный в семье пробанда, позволил выявить двух носителей данной мутации, у которых клинические проявления атеросклероза отсутствовали. Эти больные взяты под наблюдение, что позволит проследить фенотипическую экспрессию данной мутации и оценить эффективность мер первичной профилактики атеросклероза у ее носителей. Работа демонстрирует преимущества методов ДНК-анализа для обнаружения СГХС на доклинической стадии.
Ключевые слова:
Многочисленные исследования убедительно показали, что повышенный уровень холестерина (ХС) в крови сопровождается увеличением риска развития атеросклероза и его осложнений [1]. Этот риск особенно велик при первичных моногенных гиперхолестеринемиях, наиболее изученной формой которых является семейная гиперхолестеринемия (СГХС) [2]. При этом заболевании в результате мутации нарушается функционирование мембранного белка-рецептора липопротеидов низкой плотности (ЛПНП-рецептора). Этот наследственный дефект приводит к снижению клиренса липопротеидных частиц и вследствие этого к резкому повышению уровня ХС в плазме крови [3]. В настоящее время разработаны разнообразные лекарственные и афферентные способы коррекции гиперхолестеринемии [1, 4]. Клинические исследования продемонстрировали высокую эффективность этих методов для первичной и вторичной профилактики атеросклероза, в том числе у больных с СГХС [5-9]. К сожалению, клиническая и биохимическая диагностика СГХС сопряжена с определенными сложностями, вследствие чего даже в лучших клиниках диагноз СГХС в большинстве случаев ставится лишь после появления клинической симптоматики [4]. В результате диетические и лекарственные способы первичной профилактики атеросклероза у таких больных не используются в должной мере. Согласно оценкам экспертов ВОЗ, наиболее эффективным способом обнаружения СГХС на доклинической стадии является анализ ДНК родственников больных с установленным генетическим дефектом [10]. В настоящей работе этот подход был применен для проведения доклинической диагностики в семье пробанда, у которого мы обнаружили не описанную ранее перестройку в гене ЛПНП-рецептора. В результате ДНК-обследования трех поколений этой семьи, помимо пробанда, были обнаружены два носителя мутации, у которых атеросклероз не достиг клинической стадии.
Материал и методы
В работе использованы соли и буферы производства фирмы "Sigma" (США), реактивы для электрофореза и стандарты размера ДНК фирмы "Life Technologies" (Ве-ликобритания), а также реактивы для полимеразной цепной реакции (ПЦР) фирмы "Promega" (США).
Скрининг на выявление мутаций в гене ЛПНП-рецептора проведен среди больных с клиническими признаками СГХС, наблюдавшихся в Институте клинической кардиологии им. А.Л. Мясникова Российского кардиологического научно-производственного комплекса Минздрава Российской Федерации. Большинство обследованных были русской национальности и проживали в Москве и Московской области. Диагноз СГХС ставили на основании следующих критериев: при уровне общего ХС выше 7,8 ммоль/л, наличии сухожильных ксантом у обследуемого или родственников первой степени родства и отсутствии заболеваний, приводящих к развитию вторичной гиперлипопротеидемии, таких как сахарный диабет, гипотиреоз и нефротический синдром.
Анализ липидов крови проводили на анализаторах "Technicon-RX" (фирма "Technicon", США) и "Spectrum" (фирма "Abbott Laboratories", США). ХС ЛПВП определяли в супернатанте после преципитации апо-B-содержащих липопротеидов декстрансульфатом.
ДНК выделяли из крови или буккального мазка обследуемых лиц с помощью стандартных процедур [11]. ПЦР (35 циклов) проводили в термоциклере фирмы "Hybaid" при следующих условиях: денатурация (94?С, 30 с), отжиг (57?С, 30 с) и элонгация (72?С, 32 с). В конце реакции пробирки дополнительно инкубировали при 72?С в течение 10 мин. ПЦР проводили в объеме 20 мкл в растворе следующего состава: 100 мМ трис-HCl, pH 8,3 (25?С), 50 мМ KCl, 1,5 мМ MgCl2, четыре
дезоксинуклеозидтрифосфата (каждый в концентрации 100 мкМ), по 10 пмоль каждого праймера, 2 ед. Taq-полимеразы и 1 мкг геномной ДНК. Для амплификации 3-го экзона гена ЛПНП-рецептора использовали следующие праймеры [12]: 5'-TTCCTTTGAGTGACAGTTCAATCC-3' и 5'-GAT-AGGCTCAATAGCAAAGGCAGG-3'.
После окончания ПЦР 3 мкл продукта смешивали с 20 мкл 7,5% раствора фикола-400 и 0,025% ксиленцианола FF, нагревали 2 мин при 95?С, после чего пробирки немедленно помещали на лед. Продукты ПЦР анализировали с помощью электрофореза в неденатурирующем полиакриламидном геле (T=15%, C=2%) размером 160Х140Х0,75 мм. В качестве гелевого и электродного буфера использовали 1ХTBE. Форез проводили в течение ночи при 4?С и фиксированной силе тока 10 мА/гель. После окончания электрофореза гель окрашивали серебром [13]. Амплифицированные фрагменты из образцов с аномальной картиной миграции одноцепочечной ДНК очищали из исходной ПЦР-смеси электрофорезом в 8% полиакриламидном геле в TBE-буфере без предварительной денатурации, после чего их обнаруживали в геле с помощью бромистого этидия, вырезали и элюировали из геля водой. После переосаждения и измерения концентрации полученную ДНК секвенировали.
Нуклеотидную последовательность продуктов ПЦР определяли методом циклического секвенирования с использованием набора ABI PRISM и автоматического ДНК-секвенатора 375А фирмы "Applied Biosystems". Секвенирование проводили дважды с использованием прямого и обратного праймеров.
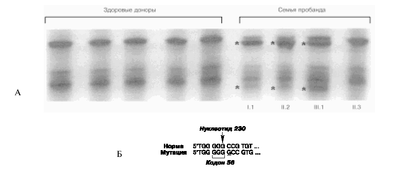 |
| Рис.1. Новая мутация в 3-м экзоне гена ЛПНП-рецептора.
А - детекция мутации с помощью электрофореза ДНК в неденатурирующем геле. Показана картина, характерная для нормохолестеринемических доноров, пробанда и членов его семьи. Звездочками обозначены полосы, отсутствующие в норме; Б - результаты секвенирования мутантной ДНК. Показаны инсерция G и связанный с этим сдвиг рамки считывания. |
Результаты исследования
Для поиска мутаций в гене ЛПНП-рецептора мы использовали метод анализа конформации одноцепочечной ДНК с помощью гель-электрофореза [14]. В ходе скрининга больных с клиническим диагнозом СГХС мы обнаружили пациента (пробанд, обозначенный на рис.1 и 2 цифрами I.1), у которого в амплифицированном 3-м экзоне на электрофореграмме наблюда-лись дополнительные полосы (на рис. 1, А обозначены звездочками). Секвенирование ДНК пациента I.1 показало наличие в одном из аллелей дополнительного нуклеотида G после нуклеотида с порядковым номером 230 [15]. Согласно распространенной номенклатуре, такую мутацию сокращенно следует обозначать 230insG [16]. Результатом этой инсерции является сдвиг рамки считывания начиная с 57-го кодона (см. рис.1, Б). В результате образуется преждевременный стопкодон в положении 108. Таким образом, в отличие от нормальной последовательности, содержащей 860 аминокислотных остатков, мутантная мРНК кодирует сильно укороченный полипептид длиной 108 аминокислот, 56 из которых соответствуют половине лигандсвязывающего домена ЛПНП-рецептора, а остальные представляют собой бессмысленную последовательность, вызванную сдвигом рамки. На основании имеющейся информации о функциональных последствиях различных типов мутаций ЛПНП-рецептора [17] можно с высокой вероятностью предположить, что данный полипептид не способен связывать липопротеиды и скорее всего в процессе созревания не достигает клеточной поверхности. Такую мутацию можно отнести ко II функциональному классу [17]. Результатом подобных нарушений в гетерозиготном состоянии обычно является утрата половины ЛПНП-связывающей способности клеток за счет полной инактивации мутантного аллеля. Анализ электронных баз данных [18, 19] показал, что такая мутация обнаружена нами впервые и, по-видимому, является специфичной для России.
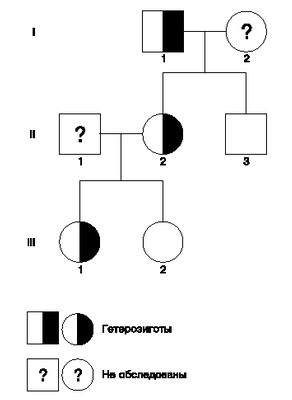 |
| Рис.2. Родословная пробанда с мутацией 230insG.
Родословная составлена на основе результатов тестирования ДНК пациентов на наличие мутации 230insG (см. рис.1, А). |
Далее...
Написать комментарий
|

