|
Шенин Ю.Д., Белахов В.В., Шатик Л.И., Аравийский Р.А. АО "Научно-исследовательский технологический институт антибиотиков и ферментов медицинского назначения", Санкт-Петербург
В начало...
Реакции полиенового макролидного антибиотика амфотерицина В с перфторангидридами карбоновых кислот приводят к получению его N-перфторацилпроизводных. В работе изучены физико-химические и медико-биологические свойства полученных производных амфотерицина В. Биологическими испытаниями выявлено, что острая токсичность (LD50) фторорганических производных в 2 раза меньше, чем у исходного антибиотика. Полученные производные амфотерицина В обладали высокой противогрибковой активностью в отношении широкого набора тест-культур.Ключевые слова:
Полиеновые макролидные антибиотики находят широкое применение в медицинской практике для лечения как поверхностных, так и глубоких микозов [1, 2]. В последние годы перспективы медицинского применения этих антибиотиков возросли в связи с выявлением противовирусной активности, а также с введением полиеновых макролидов в систему комплексного лечения онкологических заболеваний [3, 4]. Среди полиеновых макролидов основным лекарственным препаратом является амфотерицин В благодаря своей высокой активности и широкому спектру действия. В то же время за последние десятилетия создана серия высокоэффективных синтетических химиотерапевтических препаратов для лечения микозов [5]. Но даже в условиях широкого применения препаратов группы азолов, 5-фтор-цитозина, производных аллиламина, тиокарбамата и других синтетических противогрибковых лекарственных средств амфотерицин В до сих пор рассматривается как "золотой стандарт" для антимикотиков [5, 6], являясь основным препаратом сравнения в эксперименте и важнейшим средством (препаратом выбора) лечения генерализованных и глубоких микозов [1, 2, 7, 8]. Особое значение амфотерицин В приобретает при лечении грибковых заболеваний, осложняющих СПИД [2, 9].
Вместе с тем высокая токсичность (в частности, нефротоксичность) амфотерицина В [10], низкая всасываемость из желудочно-кишечного тракта [4, 7], целый ряд побочных реакций [8], плохое проникновение в спинномозговую жидкость [5] стимулировали интенсивные поиски полусинтетических производных этого полиенового антибиотика. В последние годы синтезированы различные производные амфотерицина В: N-ацильные [11, 12] О-метилоксим- [13], кремний- и серуорганические производные [14-16], метиловые эфиры 14-гидроксиамфотерицина В [17, 18], гидрофосфорильные производные [19]. Продолжая исследования по поиску новых полусинтетических производных полиеновых макролидных антибиотиков, мы изучили реакции амфотерицина В с фторорганическими соединениями и противогрибковую активность полученных производных.
Физико-химические исследования
В работе использовали амфотерицин В производства Курганского комбината медицинских препаратов и изделий "Синтез" с биологической активностью 750 ЕД/мг, удельные показатели поглощения (Е1%1 см) составляли 787, 1379, 1568 при длинах волн 363, 383 и 406 нм соответственно. Перфторангидриды карбоновых кислот были получены в Институте прикладной химии (Санкт-Петербург). Органические растворители очищали по методикам, описанным в [20].
Спектры 1Н ЯМР получены на приборе "Bruker AC-200" (Германия) с рабочей частотой 200 МГц, внутренний эталон - гексаметилдисилозан. Спектры 19F получены на приборе "Bruker AC-270" (Германия) с рабочей частотой 270 МГц, химические сдвиги 19F определены относительно внешнего стандарта СF3COOH. ИК-спектры регистрировали на спектрофотометре "Specord UV-VIS" (Германия). Индивидуальность производных амфотерицина В контролировали с помощью ТСХ на пластинах "Silufol UV-254" (Чехия) в различных системах растворителей. Проявление веществ на хроматограммах осуществляли с помощью УФ-излучения. Найденные величины элементных анализов соответствуют вычисленным.
N-(1,1,1-трифтор-2-оксоэтил) амфотерицин В (I). К 0,5 г амфотерицина В в 50 мл сухого метанола при интенсивном перемешивании добавляли 0,1 г NaHCO3 и 0,1 мл ангидрида трифторуксусной кислоты в 5 мл сухого метанола при 0?С в атмосфере аргона. Реакционную смесь выдерживали при этой температуре 1 ч, затем 2 ч при 25?С. Контроль за ходом процесса проводили с помощью ТСХ в системе этанол-аммиак-вода (8:1:1). По окончании реакции растворитель удаляли в вакууме, осадок промывали охлажденным метанолом, ацетоном, эфиром и сушили в вакууме в течение 3 ч при 40?С. Получили соединение (I) в виде мелких кристаллов желтого цвета.
N-(3-оксоперфторпропил-, гептил-, нонил-) амфотерицин В (II-IV). Получали аналогично соединению (I), используя соответствующие перфторангидриды карбоновых кислот. Соединения (II-IV) представляли собой мелкие кристаллы желтого или темно-желтого цвета.
Медико-биологические испытания
В качестве препарата сравнения при проведении всех медико-биологических испытаний использовали амфотерицин В. Острую токсичность фторорганических производных амфотерицина В (I-IV) изучали на беспородных белых мышах-самцах массой 18-20 г. Соединения (I-IV) разбавляли 0,5% водным раствором карбоксиметилцеллюлозы и в виде суспензии испытывали при внутрибрюшинном введении. По результатам испытаний рассчитывали LD50 полученных производных амфотерицина В (I-IV) методом Кербера.
Определение противогрибковой активности фторорганических производных амфотерицина В (I-IV) в отношении возбудителей различных грибковых инфекций проводили методом серийных разведений в жидкой питательной среде. Минимальная фунгистатическая концентрация (МФсК) устанавливалась по результатам визуальной оценки интенсивности роста тест-культуры в опытных и экспериментальных пробирках (при трех повторностях).
Показано, что в результате реакций амфотерицина В с перфторангидридами карбоновых кислот образуются соответствующие N-перфтор-ацилпроизводные амфотерицина В (I-IV) (рисунок). В работе использовали следующие ангидриды: трифторуксусный ангидрид, ангидриды перфторпропионовой, перфторгептановой (перфторэнантовой) и перфторнонановой (перфторпеларгоновой) кислот.
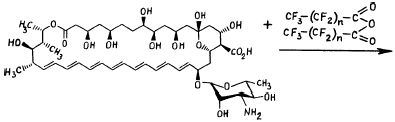 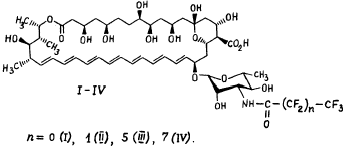 |
| Рисунок. Схема образования N-перфторацилпроизводных амфотерицина В (I-IV) при взаимодействии амфотерицина В сперфторангидридами карбоновых кислот. |
Полученные фторорганические производные амфотерицина В (I-IV) представляют собой твердые вещества, не имеющие четкой температуры плавления и разлагающиеся при нагревании. Соединения (I-IV) легко растворяются в диметилсульфоксиде и диметилформамиде, ограниченно растворяются в метаноле, этаноле, пиридине и диоксане, не растворяются в воде, ацетоне, хлороформе, эфире, бензоле, гексане.
Физико-химические характеристики и спектроскопические данные фторпроизводных амфотерицина В представлены в табл. 1. Структура полученных соединений подтверждена с помощью спектроскопии ЯМР (1Н и 19F), ИК- и УФ-спектроскопии.
| Таблица 1. Физико-химические характеристики и данные спектроскопии фторорганических производных амфотерицина В |
| Соединение |
Выход, % |
Т.пл., ?С (разл.) |
ТСХ, Rf в системах |
ЯМР 19F, 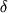 , м.д.* , м.д.* |
ИK-спектр vмакс., см-1 |
УФ-спектр 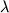 , нм (Е1%1см ) , нм (Е1%1см ) |
Брутто-формула |
| 1 |
2 |
3 |
N-H |
CF2 |
CF3 |
| I |
71 |
125-131 |
0,57 |
0,70 |
0,44 |
7,85(c, CF3) |
1477 |
1243 |
1319 |
361 (777)
382 (1359)
406 (1550) |
C49H72F3NO18 |
| II |
65 |
137-142 |
0,45 |
0,62 |
0,37 |
7,49(c, CF3)
49,36[д, CF2, J(CF2, CF3)] 0,8 Гц |
1483 |
1231 |
1327 |
362 (779)
383 (1364)
405 (1555) |
C50H72F5NO18 |
| III |
57 |
121-127 |
0,31 |
0,53 |
0,29 |
6,95(c, CF13); 46, 19[дд, CF22, J(CF22, CF32) 1,2 Гц, J(CF22, CF12) 4,6 Гц]; 31,25 (м, CF32-CF42-CF52); 39,73[д, CF62, J(CF52, CF62) 0,8 Гц] |
1480 |
1226 |
1332 |
362 (775)
382 (1357)
406 (1547) |
C54H72F13NO18 |
| IV |
52 |
144-149 |
0,27 |
0,47 |
0,21 |
7,17(c, CF13); 43,36[дд, CF22 J(CF22, CF33) 1,2 Гц, J(CF22, CF3) 5,2 Гц]; 30,51[м, (CF32-CF42-CF52-CF62-CF72-)]; 37, 64 [д, CF2, J(CF62, CF52) 1,0 Гц] |
1472 |
1249 |
1340 |
361 (773)
383 (1361)
406 (1552) |
C56H72F17NO18 |
Примечание. Системы растворителей: 1) хлороформ-метанол-н.-пропанол-боратный буфер рН 8,14 (3:2:2:1); 2) этанол-аммиак-вода (8:1:1), 3) метиленхлорид-метанол (10:3).
*) Для интерпретации спектров ЯМР 19F соединения (III) и (IV) записаны в следующем виде: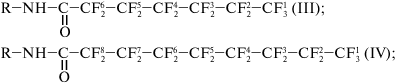
R - остаток амфотерицина В.
В 1Н ЯМР спектрах соединений (I-IV) отмечаются сигналы протонов, присущие амфотерицину В, протон при атоме азота представлен уширенным синглетом в области 5,57-5,61 м.д. Химические сдвиги 19F фторорганических производных амфотерицина В, приведенные в табл.1, характерны для N-ацилперфторпроизводных аминосахаров [21-23]. Константу спин-спинового взаимодействия (CF2, CF3) в ряде случаев практически невозможно идентифицировать, т.к. ее величина менее 1 Гц, что также соответствует аналогичным параметрам спектров 19F ЯМР для перфторзамещенных производных алифатического ряда [20, 24].
В ИК-спектрах соединений (I-IV) кроме полос поглощения, характерных для исходного амфотерицина В, присутствуют полосы поглощения в областях 1226-1249, 1319-1340 и 1472-1483 см-1, свидетельствующие о наличии групп СF2, CF3 и NH соответственно (см. табл. 1).
В электронных спектрах поглощения фторорганические производные амфотерицина В (I-IV) имеются максимумы поглощения, характерные для гептаеновой сопряженной системы.
Как показали результаты испытаний, острая токсичность соединений (I-IV) в 2 раза меньше, чем у исходного антибиотика. Так, величина LD50 N-перфторацилпроизводных амфотерицина В (I-IV) варьировала от 625 до 710 мг/кг. Далее...
Написать комментарий
|

