Георгий Николаевич Никонов, доктор химических наук, заведующий лабораторией Института органической и физической химии
им. А.Е.Арбузова Казанского научного центра РАН. Научные интересы связаны с химией гетероциклических соединений,
конформационным анализом, фосфорорганической и супрамолекулярной химией.
Как известно, самое интересное
может быть получено на стыке
разных областей знания, именно в этом случае вероятность найти что-то новое -
наибольшая. Один из примеров подобного рода - работа в области химии фосфор-
борсодержащих соединений, т.е на стыке двух ветвей: фосфорорганической химии и
химии органических соединений бора.
Фосфор и бор - это элементы противоположных свойств, антиподы. В
соединениях трехвалентного фосфора его атом обладает неподеленной электронной
парой и выступает в роли донора электронов, а сами соединения представляют собой
основания. Соединения трехвалентного атома бора - это кислоты Льюиса, атом бора в
них неподеленной электронной пары не имеет, зато у него есть вакантная орбиталь и
потому является акцептором электронов. Вот почему было бы заманчиво объединить
эти два разнохарактерных атома в одной молекуле, ведь это должно привести к новым
свойствам. Впрочем, подобные соединения известны давно и называются они
фосфинобораны и фосфинбораны.
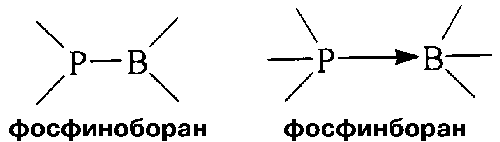 |
В таких молекулах атомы фосфора и бора связаны прочной химической связью:
как отрицательный заряд притягивается к положительному, так и неподеленная пара
электронов фосфора стремится заполнить вакантную орбиталь атома бора. И все бы
хорошо, но связанные друг с другом атомы этих элементов как бы утрачивают свою
индивидуальность. А согласитесь, интереснее получить такие молекулы, в которых
наряду со специфическими, типичными для каждого элемента свойствами, появились
бы и новые качества, обусловленные их взаимодействием. Иными словами, это были бы
вещества со свойствами, унаследованными от обоих "родителей" да еще и обладающие
своим особым характером. Для этого надо разнести атомы-антагонисты на некоторое,
не очень большое расстояние. Такие исследования были начаты в одной из
лабораторий нашего института.
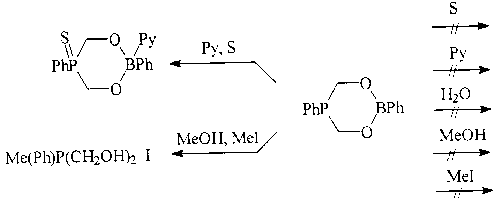
Первоначально были синтезированы в общем-то довольно простые циклические
соединения - диоксаборафосфоринаны, в которых сразу же обнаружилась интересная
особенность: в них атомы фосфора и бора взаимодействуют между собой, будучи
разделенными двумя другими атомами1.
Эти циклические соединения, по существу представляющие комбинацию
фосфина и борной кислоты, проявляют аномальные свойства: в отличие от своих
"родителей" гораздо более устойчивы, т.е. выдерживают атаки как по атому фосфора,
так и по атому бора. Налицо взаимодействие, причем внутримолекулярное. Благодаря
этому атомы фосфора и бора "помогают" друг другу выстоять при действии таких
активных реагентов, как вода, йодистый метил, спирт. Однако, если действовать
одновременно по двум атомам, реакции все-таки идут и соединения проявляют
свойства, типичные как для фосфинов, так и для борных кислот.
 |
 |
Внутримолекулярное взаимодействие гетероатомов проявляется не только в
реакционной способности, но и во "внешнем облике" молекулы, т.е. в ее
пространственном строении. Хорошо известно, что заместители в циклических
молекулах занимают такое положение, при котором они меньше всего мешают друг
другу. Благоприятной чаще всего бывает экваториальная ориентация. А вот в молекуле
диоксаборафосфоринана фенил при атоме фосфора направлен вверх относительно
плоскости гетероцикла, т.е. занимает аксиальное, стерически менее выгодное
положение.
Примечательно, что из ста молекул, находящихся в растворе, такую форму имеют
94, а в кристаллах - все молекулы. И причина этого во внутримолекулярном
электронном взаимодействии: атом бора оттягивает на себя недостающие ему
электроны с атомов кислорода, а атом фосфора подает "излишек" своих электронов на
связи С-О, причем это возможно из-за экваториального положения атома фосфора.
Именно такое положение обусловливает аксиальную ориентацию фенила.
За счет внутримолекулярного донорно-акцепторного взаимодействия по связям и
возникают необычные свойства веществ, ведь атомы фосфора и бора дезактивированы
смещением электронной плотности.
Но в одной молекуле атомы этих элементов могут взаимодействовать между собой
и иначе. Все зависит от разделяющего их фрагмента и пространственной структуры
молекулы. Например, если атом фосфора способен "дотянуться" до атома бора, он
может отдавать тому свои электроны непосредственно через пространство, как в
борилфосфиналкенах, которые иногда даже считают четырехчленными циклами2.
В противоположность этому структура орто-борилфениленфосфинов такова, что
фосфор не в состоянии "дотянуться" до атома бора - фениленовый фрагмент слишком
"жесткий" для того, чтобы можно было исказить валентные углы.
Заменой фрагментов между атомами фосфора и бора были получены
диоксаборинаны с экзоциклическим (не входящим в состав гетероцикла) фосфиновым
фрагментом3.
1 Ерастов О.А., Никонов Г.Н. Функциональнозамещенные фосфины и их производные. М., 1986; Arbuzov B.A., Nikonov G.N. // Reviews on Heteroatom Chemistry. 1990. V.3. P.1-24; Ibid. // Advances in Heterocyclic Chemistry. 1994. V.61. P.60-141.
2 Балуева А.С., Никонов Г.Н., Арбузов Б.А. // Изв. АН СССР. Сер. хим. 1991. N 10. С.2397-2399.
3 Балуева А.С., Прохорова С.Р., Никонов Г.Н. // Изв. РАН. Сер. хим. 1992. N 1. С.196-201;
Nikonov G.N., Balueva A.S., Karasik A.A. et al. // Heteroatom. Chem. 1994. V.5. N 1. P.43-49;
Балуева А.С., Карасик А.А., Никонов Г.Н. // Журн. общ. химии. 1994. Т.64. N 8. С.1403-1406;
Балуева А.С., Карасик А.А., Аюпова Э.И. и др. // Там же. N 11. C.1792-1797;
Балуева А.С., Аюпова Э.И., Никонов Г.Н. и др. // Изв. РАН. Сер. хим. 1994. N 9. C.1649-1655;
Аюпова Э.И., Балуева А.С., Никонов Г.Н., Мусин Р.З. // Журн. общ. химии. 1995. Т.15. N 12. С.1979-1982.
Вперед
Написать комментарий
|

