|
(Обзор литературы)
В.А. Бурлев, А.С. Гаспаров, Н.С. Аванесян, Н.И. Волков, Д.А. Стыгар РНИЦ акушерства, гинекологии и перинатологии РАМН, Москва
В начало...
Представлены современные данные о системе факторов роста, механизме их действия, взаимосвязи с клеточным циклом; рассмотрены некоторые из наиболее изученных факторов роста, их экспрессия в тканях яичников и эндометрия в норме и при различных патологических состояниях. Более подробно представлены инсулино-подобные факторы роста и их роль в регуляции репродуктивной функции у больных с синдромом поликистозных яичников.
Ключевые слова:
Углубленные исследования реакции клеток на гормональные воздействия позволили выявить сложную систему местных специфических факторов, осуществляющих контроль роста и дифференциации различных видов клеток путем изменения их протеолитической активности. Среди факторов межклеточного взаимодействия важную роль играют ростовые факторы.
Факторы роста (ФР) - биологически активные соединения, стимулирующие или ингибирующие деление и дифференцировку различных клеток и являющиеся основными переносчиками митогенного сигнала клетки. В отличие от гормонов ФР, как правило, продуцируются неспецифическими клетками, находящимися во многих тканях.
Система ФР включает: 1) полипептидные ростовые факторы; 2) специфические клеточные рецепторы; 3) связывающие белки, регулирующие количество ФР, действующие на клетки-мишени.
ФР могут оказывать действие различными путями: 1) аутокринным - путем воздействия на клетки, являющиеся непосредственным источником ФР; 2) паракринным - путем воздействия на клетки, расположенные вблизи клеток продуцентов; 3) интракринным - ФР остаются внутри клетки и действуют непосредственно как внутриклеточные мессенджеры; 4) эндокринным - воздействие на удаленные клетки-мишени.
Наиболее изученные ФР: инсулиноподобные факторы роста (ИФР), эпидермальный фактор роста (ЭФР), сосудистый эндотелиальный фактор роста (СЭФР), фактор роста тромбоцитов (ФРТ), трансформирующие факторы роста (ТФР-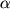 , ТФР- , ТФР- ), колониестимулирующий фактор роста, фактор роста фибробластов (ФРФ), фактор некроза опухолей- ), колониестимулирующий фактор роста, фактор роста фибробластов (ФРФ), фактор некроза опухолей-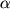 (ФНО- (ФНО-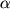 ), а также интерферон-2, интерлейкин-1, эндотелин-1. Все они относятся к факторам, стимулирующим рост клеток, за исключением интерферона-2, который является ингибитором роста, а ТФР- ), а также интерферон-2, интерлейкин-1, эндотелин-1. Все они относятся к факторам, стимулирующим рост клеток, за исключением интерферона-2, который является ингибитором роста, а ТФР- , ФНО- , ФНО-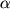 выступают и как стимуляторы, и как ингибиторы роста. выступают и как стимуляторы, и как ингибиторы роста.
ФР оказывают свое действие на различные фазы клеточного цикла. Известно, что клеточный цикл активно делящихся клеток состоит из четырех фаз [13] (схема 1). Синтез ДНК происходит во время ограниченного периода интерфазы (S-фазы).
 |
Схема 1. Схематическое изображение клеточного цикла. Примечание: S фаза - синтез ДНК, G2 фаза -интервал до митоза, М фаза - митоз, G1 фаза - интервал до синтеза ДНК, R - ограничительная точка (см.текст). |
G1 - интервал между окончанием митоза и началом S-фазы. G2 - интервал между окончанием S-фазы и началом деления клетки, а М-фаза - период митоза и цитокинеза. Неделящиеся клетки находятся в состоянии покоя (G0-фазе). Клеточный цикл имеет две важнейшие точки регуляции, на которые оказывают воздействие ФР; эти точки различаются во времени и реагируют на разные митогены. Этими точками являются 1) ограничительная точка, в которой клетка нацеливается (становится обязанной) вступить в S-фазу; эта точка примерно на 2 ч предшествует началу синтеза ДНК; 2) присутствующая у неделящихся (с остановившимся ростом) клеток точка, расположенная в начале перехода от G0-фазы к G1-фазе [67]. ФРТ - фактор <дееспособности>, который стимулирует переход неделящихся клеток из фазы G0 в фазу G1 и их становление, таким образом, способными к делению. ИФР-I - фактор <прогрессии>, присутствие которого необходимо в G1-фазе, а также для вступления в S-фазу. ЭФР занимает промежуточное положение: он необходим в интервале между 2 и 6 ч после стимуляции ФР тромбоцитов выхода клетки из фазы G0. В отличие от этого ингибитор роста ТФР- блокирует переход из фазы G0 в фазу G1. блокирует переход из фазы G0 в фазу G1.
Остановимся на некоторых из наиболее изученных ФР, их экспрессии в яичниках и эндометрии при нормально функционирующих яичниках и при различных патологических состояниях.
ИФР, или соматомедины, представляют собой группу гормонов роста, которые структурно похожи на инсулин и имеют широкие митогенные и метаболические эффекты [36]. Они обозначены как ИФР-I и ИФР-II из-за их крайней гомологии по структуре с инсулином. Сами по себе пептиды гомологичны инсулину на 62%. Рецептор инсулина имеет 1355 или 1367 аминокислот. Выясненная последовательность для ИФР-I соответствует белку с 1337 аминокислотами. Однако ген для инсулинового рецептора локализуется в хромосоме 19, в то время как ген для рецептора ИФР-I идентифицирован на дистальном участке длинного плеча хромосомы 15. Таким образом, два рецептора (рецепторы ИФР-I и инсулина) являются продуктом различных генов и соответственно регулируются различными регуляторными системами. Недавно была клонирована последовательность нуклеотидов для рецептора ИФР-II. Рецептор второго типа идентичен рецептору манноза-6-фосфат, который, по общему убеждению, вовлечен во внутриклеточный транспорт лизосомальных ферментов [64].
В дополнение к связыванию их рецепторов на клеточной мембране ИФР также с высокой активностью связываются с семейством структурно похожих циркулирующих ИФР-связывающих протеинов (ИФРСП) [2]. Хотя первично они были найдены в сыворотке [3], в настоящее время эти белки обнаружены в большом спектре биологических жидкостей, включая амниотическую, цереброспинальную, семенную, фолликулярную [57,61], также, как и в различных культуральных клеточных линиях [66]. Эти циркулирующие белки пролонгируют период полураспада ИФР и, таким образом, регулируют эндокринные эффекты этих факторов.
Печень является главным источником циркулирующих ИФР [5].
У женщин с нормальным менструальным циклом циркулирующий уровень ИФР-I и ИФР-II не имеет различий в фолликулярную и лютеиновую фазы цикла [56]. Концентрация обоих в сыворотке также не изменяется при стимуляции овуляции человеческим менопаузальным гонадотропином [50,70]. Концентрация ИФР-II (но не ИФР-I) при исследовании была значительно выше в яичниковой вене, что также свидетельствует о яичниковом источнике этого пептида [56]. Доминантный фолликул содержит ИФР-I в большей концентрации, чем недоминантные когорты [39,40]. Более того, уровень ИФР-I в фолликулярной жидкости положительно коррелирует как с концентрацией эстрадиола, прогестерона, так и с объемом фолликулярной жидкости [39,40,74]. В исследованиях [41] методом in situ гибридизации транскрипты ИФР-I были обнаружены в теке малых (3-5 мм) развивающихся фолликулов и атретических фолликулах, но не найдены в гранулезных клетках. Однако ИФР-II мРНК наиболее часто встречались в гранулезных клетках больших развивающихся фолликулов и в желтом теле. Низкий уровень ИФР-II мРНК и связывающего протеина ИФР-II был обнаружен в текаклетках женщин с синдромом поликистозных яичников (СПКЯ), также как и в малых антральных фолликулах у нормально функционирующих женщин. Кроме того, обильная экспрессия ИФР-II мРНК и связывающего белка встречается в гранулезных клетках доминантного фолликула. Это привело к гипотезе <переключения> генной экспрессии ИФР-II из текаклеток на гранулезные клетки с созреванием малых антральных фолликулов в доминантные, которые представляют отличительный признак человеческого фолликулогенеза. Более того, отсутствие подобного перемещения в фолликулах при СПКЯ может объяснять <арест> фолликула, имеющийся в этих условиях.
Более подробно остановимся на СПКЯ и ИФР. Известно, что СПКЯ - мультифакторная патология, для которой характерны олиго/аменоррея, хроническая ановуляция, гиперандрогения и, как следствие, гирсутизм и бесплодие [31]. Патогенез СПКЯ остается не до конца ясным, несмотря на большое количество исследований в этой области. Ведущей является центральная теория патогенеза, согласно которой данное патологическое состояние объясняется нарушениями образования нейротрансмиттеров в гипоталамической области, изменением цирхорального ритма выделения гонадотропин-рилизинг-гормона (ГнРГ) и, как следствие, количественными изменениями секреции гонадотропных гормонов: лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) [1,4,66,79,81,84]. Причины возникновения такого состояния остаются невыясненными; возможно, это связано с генетически детерминированным нарушением ритма и количества выделения ГнРГ.
Хотя патофизиология СПКЯ недостаточно ясна, в яичниках при данном патологическом состоянии не происходит селекции доминантного фолликула, а имеются множество малых (<10 мм) фолликулов. Инсулинорезистентность и как следствие гиперинсулинемия вовлекаются в патогенез этого синдрома [11,24]. Роль инсулина в СПКЯ базируется на следующих заключениях: а) рецепторы для инсулина и структурно связанных ИФР-I были идентифицированы в тканях человеческого яичника [72]; б) инсулин стимулирует продукцию андрогена текаклетками и стромой культивированных клеток у женщин с гиперандрогенией и нормальных женщин [10]; в) инсулин усиливает ответ текаклеток и стромы на гонадотропины [42]; г) при некоторых синдромах вторичной резистентности инсулина, в основе которых лежит мутация гена инсулинового рецептора, встречается гиперандрогения [6,63]; д) кратковременное подавление уровня сывороточного инсулина уменьшает уровень сывороточного андрогена у некоторых пациенток с СПКЯ [65]. Инсулинорезистентность часто встречается и у тучных пациенток и у женщин с нормальной массой и не зависит от массы тела [22,37]. P. Richard и соавт. [78] исследовали реакцию инсулина при определении глюкозотолерантного теста per os и внутривенно у женщин с СПКЯ и без данной патологии. При сравнении с контролем у женщин с СПКЯ уровень инсулина был увеличен на 44 и 53% соответственно [22]. Более того, эти различия были относительно не связаны с индексом массы тела. Чувствительность ИФР-I при СПКЯ не нарушена, несмотря на снижение чувствительности к инсулину [21]. Предполагается, что при инсулинорезистентных состояниях повышение уровня связывания инсулина рецепторами ИПФР-I осуществляется через феномен избытка и как результат - стимуляция теки и увеличение выработки андрогенов [12]. Эта гипотеза подтверждается структурной гомологичностью рецепторов инсулина и ИФР-I.
Далее...
Написать комментарий
|

