|
(Обзор литературы)
В.А. Бурлев, А.С. Гаспаров, Н.С. Аванесян, Н.И. Волков, Д.А. Стыгар РНИЦ акушерства, гинекологии и перинатологии РАМН, Москва
В начало...
(Продолжение)
V. Insler [52] представляет возможные патофизиологические механизмы развития СПКЯ у пациенток с повышенной и нормальной массой тела (схема 2). В первом случае имеется резистентность к инсулину и, как следствие, гиперинсулинемия, которая, с одной стороны, увеличивает количество рецепторов ИФР-I в яичниках и, с другой - приводит к снижению уровня ИФРСП-I, что увеличивает количество несвязанного ИФР-I. Увеличение количества рецепторов ИФР-I в свою очередь приводит к усилению действия ЛГ и ИФР-I на текаклетки, следствием этого является повышение выработки андрогенов. У пациенток с СПКЯ с нормальной массой тела относительное увеличение количества гормона роста стимулирует ИФР-I в гранулезных клетках, что в свою очередь паракринным путем осуществляет эффект ИФР-I на текаклетки. Это, а также относительное увеличение содержания ЛГ способствует увеличению эффекта ЛГ и ИФР-I на текаклетки. Все это приводит к увеличению секреции андрогена. Андрогены переходят в эстрогены, а это ведет к нарушению цикличности ГнРГ, что является причиной СПКЯ. Таким образом, возникает замкнутый круг.
 |
| Схема 2. Схематическое изображение возможного патофизиологического механизма развития СПКЯ у пациенток с нормальной и повышенной массой тела. Примечание. ГР - гормон роста, ИФР-I - инсулиноподобный фактор роста, ИФРР-I - рецептор инсулиноподобного фактора роста-I, ИФРСП-1 -инсулиноподобного фактора роста связывающий протеин 1, ЛГ - лютеинизирующий гормон, ГнРГ - гонадотропин рилизинг гормон (см. текст). |
Система ИФР тесно связана с нарушением развития фолликула при СПКЯ. В фолликулярной жидкости нестимулированных яичников у женщин с СПКЯ наблюдается достоверно большое содержание ИФР-I по сравнению с группой контроля. Кроме того, концентрация общего и свободного ИФР-I в сыворотке женщин с СПКЯ увеличена в сравнении сывороткой здоровых женщин [54]. Было предположено, что повышенный уровень ЛГ, часто наблюдаемый при данной патологии, может увеличивать продукцию ИФР-I текаклетками в поликистозных яичниках и продукцию андрогена [15,45]. В экспериментах с гранулезными клетками поликистозных яичников in vitro показано, что физиологическая концентрация ИФР-I по эффективности стимуляции продукции эстрадиола не уступает ФСГ [42]. Таким образом, ИПФР-I и ФСГ действуют как синергисты на увеличение продукции эстрадиола [42].
Итак, ИФР-I и ИФР-II интимно связаны с развитием фолликулов, стероидогенезом и функцией желтого тела. Эта сложная система каскадных эффектов включает гонадотропины, ФР, инсулин и семейство связывающих белков ИФР. Более глубокое изучение системы ИФР будет способствовать открытию новых перспектив в лечении таких патологических состояний, как ановуляция и гиперандрогения, а также подборе адекватного лечения бесплодных пар.
СЭФР - связывающий гепарин димерный полипептидный ФР, первоначально выделенный в чистом виде на основании его свойства усиливать проницаемость сосудов; позднее было показано, что СЭФР является мощным митогеном для эндотелиальных клеток [32,43, 85] и изменяет экспрессию нескольких протеолитических ферментов, участвующих в ангиогенезе [71, 93]. Были идентифицированы четыре вида молекул СЭФР (СЭФР 121, СЭФР 165, СЭФР 189, СЭФР 206), которые образуются за счет альтернативного мРНК-сплайсинга одного гена [92]. Пятый сплайсинговый вариант - СЭФР 145 - был выявлен в эндометрии недавно [25].
Оба известных рецептора СЭФР, присутствующих в организме человека - flt и KDR [90, 95] - являются тирозинкиназами клеточной поверхности и экспрессированы преимущественно на эндотелиальных клетках [32,43,55].
Интерес к СЭФР за последнее время особенно возрос в связи с повышенным интересом к проблеме ангиогенеза эндометриоза и патогенеза опухолевых образований яичников, а также более детальным изучением функции клеток гранулезы.
Установлено, что генитальный эндометриоз - заболевание, сопровождающееся дисменореей, болевым синдромом и бесплодием, обнаруживается более чем у 50% женщин, страдающих бесплодием [7].
Ангиогенез, вероятно, играет роль в патогенезе эндометриоза, поскольку для успешной имплантации и роста эндометриальной ткани требуется новообразование сосудов. Имплантанты эндометрия имеют склонность сопровождаться повышенным кровоснабжением, а экстрагенитальный эндометриоз обнаруживается в местах, имеющих хорошую васкуляризацию, например, в легких, коже и мышцах [76]. Перитонеальная жидкость, полученная у женщин, страдающих эндометриозом, имеет повышенную ангиогенную активность по сравнению с перитонеальной жидкостью, полученной у женщин, не имеющих данного заболевания [69,83]. Уровень ангиогенной активности эндометрия, возможно, является одной из детерминант, определяющих вероятность имплантации и прогрессирования эндометриоза.
Лучшее понимание факторов, регулирующих васкуляризацию эндометрия, позволит более эффективно лечить многие патологические состояния, включая эндометриоз, дисфункциональные маточные кровотечения и рак эндометрия.
При метастазах рака яичника происходит обильная выработка асцитической жидкости. Это навело на мысль о возможном участии СЭФР в патогенезе раковых опухолей яичников. Экспрессия СЭФР присутствует в здоровых яичниках приматов и человека [68,77]; его экспрессия повышается во многих опухолях человека (включая рак яичника) по сравнению с нормальными тканями [16,17,20,44,85]. В исследованиях с использованием реакции полимеразной цепочки выявили присутствие транскриптов, кодирующих flt и KDR в клеточных линиях рака яичника, которые также имели экспрессию мРНК СЭФР. Этот неожиданный результат позволил предположить, что СЭФР может действовать не только как ангиогенный фактор, но и более основательно - как аутокринный или паракринный регулятор роста, действующий через рецепторы, экспрессируемые опухолевыми клетками [28].
Помимо стимуляции митогенной активности, СЭФР оказывает еще несколько воздействий на эндотелиальные клетки, в том числе стимулирует синтез и высвобождение протеаз и фактора Виллебранда - посредника адгезии тромбоцитов, участвующего в коагуляции белков плазмы, высвобождающихся из кровеносных сосудов, имеющих повышенную проницаемость [19,71,93].
В процессе ангиогенеза опухолей яичников играет роль стимуляция новообразования эндотелиальных клеток, их подвижности и высвобождения ими протеаз, усиливающих проницаемость базальных мембран и внеклеточного матрикса. Ускоренное новообразование клеток и прорастание ими тканей характерны и для инвазивных опухолей; данные свойства, вероятно, обусловлены присутствием в опухолях экспрессирующих рецептор клеток в сочетании с локальным возрастанием экспрессии СЭФР. В связи с этим СЭФР и его рецепторы являются потенциально важными мишенями лечебных воздействий, направленных против рака яичника.
Недавно СЭФР, а также лептин - белок, участвующий в различных видах регулярной деятельности, включая гемопоэз [14,29], отложение жира и жировой обмен [33,97], а также репродукцию [26,27,30], присутствующие в относительно высоких концентрациях в фолликулярной жидкости человека, были идентифицированы как секреторные продукты клеток гранулезы и яйценосного бугорка (cumulus oophorus). M. Antczak и соавт. [8] описывают субпопуляции клеток гранулезы и cumulus oophorus, демонстрирующие выраженную активность и необычную морфодинамику поведения, связанную с накоплением СЭФР, лептина и ТФР- 2. Эти клетки образуют множественные баллонообразные структуры, соединяющиеся с их апикальными поверхностями посредством тонкого стебелька, образованного плазматической мембраной. Этот необычный апокриноподобный механизм наблюдался в свежевыделенных массах человеческого кумулюса и клетках гранулезы; данный феномен сохранялся и в культуре. Авторами выдвинуто предположение о том, что формирование присоединенной структуры представляет собой новый механизм накопления и секвестрации ФР, имеющий место в пре- и постовуляторных фолликулах человека; можно предположить, что данный механизм поддерживает уникальный порядок направленной секреции, который, возможно, играет роль в обеспечении быстрых подъемов клеточного роста и дифференцировки во время роста фолликула и формирования желтого тела. 2. Эти клетки образуют множественные баллонообразные структуры, соединяющиеся с их апикальными поверхностями посредством тонкого стебелька, образованного плазматической мембраной. Этот необычный апокриноподобный механизм наблюдался в свежевыделенных массах человеческого кумулюса и клетках гранулезы; данный феномен сохранялся и в культуре. Авторами выдвинуто предположение о том, что формирование присоединенной структуры представляет собой новый механизм накопления и секвестрации ФР, имеющий место в пре- и постовуляторных фолликулах человека; можно предположить, что данный механизм поддерживает уникальный порядок направленной секреции, который, возможно, играет роль в обеспечении быстрых подъемов клеточного роста и дифференцировки во время роста фолликула и формирования желтого тела.
ЭФР - полипептид, состоящий из одной цепи в 53 аминокислоты с тремя дисульфидными мостиками, которые защищают его молекулу от действия протеинкиназ. ЭФР - потенциальный митоген, стимулирующий пролиферацию многих типов клеток, включая фибробласты, кератиноциты и эпителиальные клетки [23].
Иммунореактивным методом выявлено, что ЭФР локализуется в стромальных клетках эндометрия в течение пролиферативной фазы, уровень его увеличивается в секреторную фазу. В секреторную фазу цикла обнаруживается на поверхности эпителия и вокруг спиральных артериол, во время беременности в децидуальном эпителии и в синцитиотрофобласте [49,51]. По данным других авторов, содержание ЭФР не изменяется в эндометрии на протяжении менструального цикла.
ЭФР и родственный ему ТФР-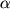 имеют общий рецептор, который кодируется геном c-erb [35]. Рецептор ЭФР (РЭФР) представляет собой одновременно и тирозинкиназу, которая активируется при взаимодействии рецептора с лигандом. Рецепторная тирозинкиназа физически связана с фосфотирозинфосфатазой, эти два фермента не просто оказывают противоположное действие (тирозинкиназа фосфорилирует белки по тирозину, а фосфатаза дефосфорилирует), их согласованная активность обеспечивает тонкий баланс в передаче эффекторных сигналов, необходимых для клеточного роста и дифференцировки [94]. Результатом фосфорилирования/дефосфорилирования ключевых клеток могут быть их активация/инактивация, открытие ионных каналов, экспрессия генов. Многие эффекты рецепторных тирозинкиназ опосредуются активацией проонкогена ras [59]. РЭФР также активирует проонкогены c-fos и c-myc [58]. имеют общий рецептор, который кодируется геном c-erb [35]. Рецептор ЭФР (РЭФР) представляет собой одновременно и тирозинкиназу, которая активируется при взаимодействии рецептора с лигандом. Рецепторная тирозинкиназа физически связана с фосфотирозинфосфатазой, эти два фермента не просто оказывают противоположное действие (тирозинкиназа фосфорилирует белки по тирозину, а фосфатаза дефосфорилирует), их согласованная активность обеспечивает тонкий баланс в передаче эффекторных сигналов, необходимых для клеточного роста и дифференцировки [94]. Результатом фосфорилирования/дефосфорилирования ключевых клеток могут быть их активация/инактивация, открытие ионных каналов, экспрессия генов. Многие эффекты рецепторных тирозинкиназ опосредуются активацией проонкогена ras [59]. РЭФР также активирует проонкогены c-fos и c-myc [58].
Во многих опухолях установлены сверхэкспрессия РЭФР или мутации в генах, кодирующих его, вероятно, ответственные за опухолевую трансформацию [35,46]. При раке предстательной железы отмечается увеличение содержания мРНК РЭФР, но уменьшение содержания самого белка при определении иммунохимическим методом. Повышенное содержание РЭФР было выявлено в опухолях яичника, матки, молочных желез, желудочно-кишечного тракта и при раке кожи. Наиболее изучено клиническое значение РЭФР при раке молочной железы. ЭФР стимулирует рост раковых клеток молочной железы и этим дополняет эстрогенстимулированный опухолевый рост. Установлено, что РЭФР опосредуют воздействие ЭФР и ТФР-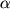 и являются прогностическими маркерами для опухолей молочной железы. В серии исследований было установлено, что высокое содержание РЭФР часто коррелирует с низким уровнем эстрогенных и прогестероновых рецепторов и сочетается с меньшей выживаемостью больных по сравнению с больными, имеющими РЭФР-отрицательные опухоли. Экспрессия РЭФР на клетках рака молочной железы является показателем не только неблагоприятного прогноза, но и низкой чувствительности к гормонотерапии, в частности к тамоксифену. и являются прогностическими маркерами для опухолей молочной железы. В серии исследований было установлено, что высокое содержание РЭФР часто коррелирует с низким уровнем эстрогенных и прогестероновых рецепторов и сочетается с меньшей выживаемостью больных по сравнению с больными, имеющими РЭФР-отрицательные опухоли. Экспрессия РЭФР на клетках рака молочной железы является показателем не только неблагоприятного прогноза, но и низкой чувствительности к гормонотерапии, в частности к тамоксифену.
Далее...
Написать комментарий
|

