|
Виноградова К.А., Котова И.Б., Додзин М.Е. Московский государственный университет им. M.B. Лoмoносова
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1999-N8, стр. 23-29 В начало...
(Окончание)
Поиски продуцентов L-глутаматоксидаз проводили среди различных культур актиномицетов - как почвенных (коллекционных или свежевыделенных), так и тех, которые в качестве среды обитания предпочитают пшеничные отруби [3, 5, 8, 12, 13, 14].
Что касается частоты встречаемости продуцентов L-глутаматоксидазы среди почвенных актиномицетов, то, согласно одному источнику, только 2 штамма из 500 проверенных показали наличие искомой активности [5], согласно другому - один продуцент был обнаружен среди 125 проверенных [21]. Скорее всего продуценты L-глутаматоксидаз не относятся к числу широко распространенных микроорганизмов.
Только один из продуцентов - Streptomyces sp. Х-119-6 - был выявлен методом учета количества потребленного кислорода с использованием кислородного электрода [3, 4]. В остальных случаях использовали описанный выше экспресс-метод, визуализирующий количество образующейся Н2О2 и основанный на цветной реакции, как наиболее удобный при проверке большого количества культур. Активные колонии отбирали по наиболее быстрому и интенсивному розовому (красному) окрашиванию [14]. Метод позволяет делать отбор уже на ранних этапах поиска продуцентов - на чашках с посевами образцов почвы, а также при селекции продуцентов - на чашках с рассевами популяции, в том числе и после обработки мутагенами. Этот качественный метод дополняется последующей количественной оценкой активности продуцента при росте на жидких средах в условиях глубинного культивирования.
Что же касается вопроса о составе среды, используемой для скрининга продуцентов L-глутаматоксидазы, есть данные о том, что наилучшие результаты отбора колоний с выраженной активностью получены на агаровой среде, содержащей экстракт пшеничных отрубей [14]. Напомним, что пшеничные отруби были единственно возможным субстратом в процессе обнаружения и изучения L-глутаматоксидазы из Streptomyces sp. Х-119-6 [3]. Следует отметить, что в одном из результативных исследований поисковая среда отличалась по составу от ферментационной, но обе не содержали отрубей [5].
В качестве приемов повышения первоначально низкой активности "диких" продуцентов L-глутаматоксидазы авторы используют как обычные методические приемы - "моноспоровая" селекция (отбор на базе естественной изменчивости культуры продуцента), селекция с применением мутагенов, в частности, N-метил-N'-нитро-N-нитрозогуанидина [5], так и предложенную оригинальную систему методических подходов - получение активных продуцентов при сочетании отбора на плотных средах после обработки мутагенами (HNО2) и культивирования активных штаммов на средах, содержащих L-глутаминовую кислоту [14].
Авторы считают, что внесение L-глутаминовой кислоты в среду угнетает рост и споруляцию малопродуктивных штаммов; при культивировании продуцентов происходит элиминирование из популяции малопродуктивных колоний и накопление высокопродуктивных [14]. Последние толерантны к повышающимся концентрациям L-глутаминовой кислоты в среде (с 0,5 до 0,9%). Предполагают, что высокопродуктивные штаммы-продуценты могут иметь двоякий механизм устойчивости: во-первых, высокие концентрации экскретируемой оксидазы разрушают L-глутаминовую кислоту, во-вторых, возможно наличие генетических изменений, состоящих в снятии азотной катаболитной репрессии, вызываемой L-глутаминовой кислотой [14].
Другим эффективным приемом, позволяющим регулировать биосинтез глутаматоксидазы в глубинной культуре, можно считать добавление определенного количества Са2+ в ферментационную среду [22]. Авторы показали, что при внесении ионов кальция в относительно большой концентрации (15-40 мМ) в среду, образование L-глутаматоксидазы значительно возрастает (с 2,5 до 6,5 ед/мл). При этом рост продуцента несколько замедляется, а количество накопленной биомассы снижается приблизительно на 30%. Продуктивность таким образом существенно возрастает (до 0,25 ед/ мл/час). При изучении динамики образования фермента показано, что при добавлении Са2+ в концентрациях 15-40 мМ максимум образования L-глутаматоксидазы достигается на 7 ч быстрее (через 26 ч ферментации), чем при исходном содержании Са2+ от 0 до 7,5 мМ.
Дополнительные эксперименты показали, что ионы Са2+ не оказывают влияние на активность L-глутаматоксидазы in vitro. Другие двухвалентные катионы, например Mg2+, не оказывали влияния на биосинтез L-глутаматоксидазы, т.е. эффект Са2+ при глубинном культивировании Streptomyces sp. N1 был специфичным. Авторы полагают, что этот прием может быть полезен для увеличения продукции глутаматоксидаз, несмотря на пока неясный механизм действия Са2+.
Что касается данных, характеризующих уровень ферментативной активности различных продуцентов, то они сильно различаются. Уровень активности культуральной жидкости продуцента S.violascens после селекции, проведенной с мутагеном N-метил-N'-нитро-N-нитрозогуанидином, составил 0,5 ед/мл [5]. Для продуцентов Streptomyces spp. А7700 и А8063 заявлена активность культуральной жидкости 0,13 и 0,59 ед/мл соответственно [8], для S.endus - 0,025 ед/мл [11], а для Streptomyces sp. X-119-6 - 0,0225 ед/мл [3, 4]. На этом фоне резко выделяются работы, посвященные продуценту Streptomyces sp. 26 и его мутантам. В результате комплекса мер по оптимизации биосинтеза из исходной культуры Streptomyces sp. 26 получен мутант Streptomyces sp. N14, активность которого превысила исходную в 80 раз и составила 14 ед/мл [14, 21, 23, 24]. Максимальная активность в культуре этого продуцента достигается через 48 ч роста [23].
Таким образом, новый фермент L-глутаматоксидаза, открытый почти одновременно разными исследователями в середине 80-х годов, и в настоящее время является объектом пристального внимания. Постоянно расширяющиеся области ее практического применения определяются, в первую очередь, насущным интересом к детекции глутаминовой кислоты в клинической и фундаментальной медицине, в фармацевтической и пищевой промышленности, в биотехнологии.
В клинической диагностической биохимии на основе глутаматоксидазы разработаны методы определения в образцах сыворотки крови, мочи и другом биологическом материале ряда веществ - глутаминовой кислоты, глутамина, NН3, мочевины, креатинина, НАДН, НАДФН, сывороточного Mg2+, а также таких ферментов, как аспартат-аминотрансфераза и аланинаминотрансфераза. Определение уровня глутаминовой кислоты играет большую роль в диагностике некоторых заболеваний печени и сердечно-сосудистой системы. Что касается фундаментальной медицины, то разработанные на основе L-глутаматоксидазы точные и быстрые методы определения глутаминовой кислоты используются для диагностики клинической картины таких серьезных заболеваний, как инфаркты, инсульты и различные нейропатологические состояния, развивающиеся при травмах центральной нервной системы. С помощью таких методов проводится исследование метаболических путей, связанных с базовыми концентрациями L-глутаминовой и 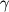 -аминомасляной кислот и активностью L-глутаматдекарбоксилазы в центральной нервной системе, при нормальном и патологическом состоянии организма. -аминомасляной кислот и активностью L-глутаматдекарбоксилазы в центральной нервной системе, при нормальном и патологическом состоянии организма.
Другой важной областью применения диагностических методов с использованием глутаматоксидазы, является фармацевтическая и пищевая промышленность, так как глутаминовая кислота входит в состав широкого спектра фармацевтических препаратов и продуктов питания.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1999-N8, стр. 23-29
1. Krebs H.A. Oxidation of amino acids. Enzymes 1951; 2: 499-512.
2. Curti В., Ronchi S., Pilone S.M. D- and L-amino acid oxidases. Chem Biochem Flavoenzymes 1992; 3: 69-94.
3. Kusakabe H., Midorikawa Y., Kuninaka A., Yoshino H. Occurence of a new enzyme, L-glutamate oxidase in a wheat bran culture extract of Streptomyces sp. X-l19-6. Agric Biol Chem 1983; 47: 1: 179-182.
4. Kusakabe H., Midorikawa Y., Fujishima T. et al. Purification and properties of a new enzyme, L-glutamate oxidase, from Streptomyces sp. X-119-6 grown on wheat bran. Agric Biol Chem 1983; 47: 6: 1323- 1328.
5. Kamei Т., Asano К., Suzuki H., Matsuzaki M., Nakamura S. L-Glutamate oxidase from Streptomyces violascens. I. Production, isolation and some properties. Chem Pharm Bull 1983; 31: 4: 1307-1314.
6. Kamei Т., Asano K., Kondo H. et al. L-Glutamate oxidase from Strep-tomyces violascens. II. Properties. Chem Pharm Bull 1983; 3l: 10: 3609-3616.
7. Ishikawa H., Misaki H., Muto N. L-Glutaminsaure - oxidase, verfahren zu deren herstellung und verwendung fur analysen-methode. Deutsch Pat DE 3307607 1983.
8. Ishikawa H., Misaki H., Muto N. L-Glutamic acid oxidase (H2O2-generating), its production and analytical method therefor. US Pat 4605615, 1986.
9. Passarge M., Bohmer A., Renneberg R., Muller H.G. Verfahren zur Herstellung einer microbiellen L-glutaminsaure - oxidase. Pat DDR, DD 240910, 1986.
10. Passarge M., Bohmer A. Verfahren zur Herstellung einer microbiellen (H2O2-bildenden) L-glutaminsaure - oxidase. Pat DDR, DD 261932, 1988.
11. Passarge M., Liebs P., Sedler H., Ganzel K. Verfahren zur Herstellung einer extrazellularen, H2O2-bildenden L-glutamatoxidase. Pat DDR, DD 272101, 1989.
12. Bohmer A., Muller A., Liebs P. et al. A novel L-glutamate oxidase from Streptomyces endus. Purification and ргореrties. Eur J Biochem 1989; 182: 2: 327-332.
13. Chen Ch.Y., Su Y.Ch. Amperometric L-glutamate sensor using a novel L-glutamate oxidase from Streptomyces platensis NTU 304. Anal Chim Acta 1991; 243: 9-15.
14. Li Q., Wang L., Li Y. Color development with rational screening method for improved L-glutamate oxidase-producing strains. Enzyme Microb Technol 1996; 18: 1: 7-9.
15. Chen Ch.Y., Su Y.Ch. Purification and physicochemical properties of thermostable L-glutamate oxidase produced by Streptomyces NTU 3304. Huibao, 1993; 142: 17-19.
16. Behlke J., Knespel A., Glaser R.W., Pleibner K.P. Analysis of infra- and intermolecular interactions in some oxidases using an analytical ultracentrifuge. Progr Colloid Polym Sci 1991; 86: 30-35.
17. Allain Ch.C., Poon L.S., Chan C.S.G. et al. Enzymatic determination of total serum cholesterol. Ciin Chem 1974; 20: 4: 470-475.
18. Kusakabe H., Midorikawa Y., Yamauchi H. L-Glutamic acid oxidase, its production, and its use. Eur Pat 0097949, 1989.
19. Гаузе Г.Ф., Преображенская Т.П., Свешникова М.А. и др. Определитель актиномицетов. М 1983; 245.
20. Li Q., Li X., Li Y., Xie X. Biosynthesis of L-glutamate oxidase by Streptomyces sp. N15 in resting cell culture system. Huadong Ligong Daxue Xuebao 1994; 20: 2: 168-172.
21. Xu S., Li Y. Screening of L-glutamate oxidase forming strains and conditions for enzyme production. Weishengwu Xuebao 1993; 33: 4: 309-312.
22. Li Q.S., Zhong J.J. Enhancement of L-glutamate oxidase production in liquid fermentation of Streptomyces sp. by calcium addition. Biotechnol Techniq 1996; 10: 6: 453-456.
23. Li Q., Zhang S., Yu J. 1,1-Dimethylferrocene mediated L-glutamate electrodes modified with electropolymerized 1,3-diaminobenzene film. Anal Lett 1995; 28: 12: 2161-2174.
24. Li Q., Zhang S., Yu J. Immobilization of L-glutamate oxidase and peroxidase for glutamate determination in flow system injection analysis system. Appl Bioch Biotech 1996; 59: 1: 53-61.
Написать комментарий
|

