|
А.В. Никитин Государственный научный центр по антибиотикам, Москва
В начало...
(Окончание)
Одним из основных факторов в развитии воспаления является повышение адгезии лейкоцитов. Среди большого многообразия молекул адгезии основная роль принадлежит лигандам LFA-1 (CD11а/CD18), экспрессированных на лейкоцитах, и ICAM-1 (CD54) на эндотелиальных клетках [9, 10]. В клинических испытаниях на 32 больных ревматоидным артритом была установлена эффективность моноклональных антител к CD54. Компания "ISIS Pharmaceuticals" разработала препарат ISIS-2302, представляющий собой антисенсингибитор синтеза 1САМ-1, который прошел клинические испытания [9]. Другим примером является применение антител к Е-селектину, которые в III фазе клинических испытаний при введении в дозах 0,1-1,0 мг/кг больным с септическим шоком, выжившим в первые 24 ч, уменьшали проявление симптомов шока и увеличивали выживаемость в течение 28 дней. Следует также отметить возможность применения гранулоцитарного колониестимулирующего фактора (ГКСФ), который на модели сепсиса у мышей повышал их выживаемость. При введении препарата ГКСФ (филгастрима) больным с сепсисом в дозе 1 мкг/кг в день отмечено снижение экспрессии молекул адгезии LАМ-1 , уровня ИЛ-8 и повышение содержания РА ИЛ-1 [6].
Наряду с иммунобиологическими препаратами, регулирующими уровни медиаторов воспаления, перспективным следует считать применение различных фармакологических средств, влияющих на факторы воспаления. К этим препаратам относят ингибиторы ФНО-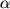 -ПФ, подавляющие посттрансляционный процессинг ФНО- -ПФ, подавляющие посттрансляционный процессинг ФНО-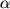 и его высвобождение из клеток. Другая группа представлена ингибиторами фосфодиэстераз (ИФДЭ), повышающих внутриклеточное содержание цАМФ и нарушающих выделение ФНО- и его высвобождение из клеток. Другая группа представлена ингибиторами фосфодиэстераз (ИФДЭ), повышающих внутриклеточное содержание цАМФ и нарушающих выделение ФНО-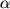 . Одним из неспецифических ИФДЭ является пентоксифиллин. Препарат влияет на различные функциональные характеристики активированных лейкоцитов и подавляет образование ФНО- . Одним из неспецифических ИФДЭ является пентоксифиллин. Препарат влияет на различные функциональные характеристики активированных лейкоцитов и подавляет образование ФНО-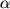 . При этом снижение уровня цитокина может происходить как вследствие неспецифического действия пентоксифиллина за счет повышения уровня внутриклеточного цАМФ, так и в результате подавления транскрипции мРНК, кодирующей ФНО- . При этом снижение уровня цитокина может происходить как вследствие неспецифического действия пентоксифиллина за счет повышения уровня внутриклеточного цАМФ, так и в результате подавления транскрипции мРНК, кодирующей ФНО-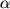 . Пентоксифиллин также ингибирует выделение ФНО- . Пентоксифиллин также ингибирует выделение ФНО-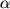 и ИЛ-1 из лейкоцитов и других клеток. Препарат повышает образование ИЛ-10 лейкоцитами человека при их стимуляции компонентами грамположительных бактерий. В этом плане перспективными являются исследования по созданию новых производных метилксантина с улучшенными фармакологическими свойствами. Среди них выделяют лизофиллин, являющийся менее токсичным метаболитом пентоксифиллина, подавляющим образование ИЛ-1 и ИЛ-1 из лейкоцитов и других клеток. Препарат повышает образование ИЛ-10 лейкоцитами человека при их стимуляции компонентами грамположительных бактерий. В этом плане перспективными являются исследования по созданию новых производных метилксантина с улучшенными фармакологическими свойствами. Среди них выделяют лизофиллин, являющийся менее токсичным метаболитом пентоксифиллина, подавляющим образование ИЛ-1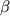 , ФНО- , ФНО-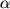 и стимулирующим выделение ИЛ-10 моноцитами человека при воздействии на них компонентов грамположительных микроорганизмов [8]. и стимулирующим выделение ИЛ-10 моноцитами человека при воздействии на них компонентов грамположительных микроорганизмов [8].
Применение неспецифического ИФДЭ пентоксифиллина у 14 больных тяжелым ревматоидным артритом вызвало существенное улучшение состояния у 50% испытуемых. Дальнейшим развитием этого направленеия является разработка спефицических ИФДЭ 4-го типа. К ним относят препараты ролипрам, денбуфиллин, BRL 610663 и ряд других. Механизм их действия включает подавление высвобождения провоспалительных цитокинов и медиаторов, ингибирование активации лейкоцитов (дегрануляции, дыхательного взрыва), миграции, экспрессии молекул адгезии, индукцию образования цитокинов с противовоспалительным действием (ИЛ-10), стимуляцию апоптоза , выделения эндогенных стероидных гормонов и катехоламинов [11]. В настоящее время разрабатываются перспективные препараты из группы кортикостероидов (глюкокортикоидов). Механизм противовоспалительного действия глюкокортикоидов заключается в подавлении деацилирования арахидоновой кислоты посредством индукции липокортина, являющегося ингибитором фосфолипазы А2. При этом наряду с подавлением образования лейкотриенов В4, С4 и тромбоксана В2 уменьшается проницаемость эндотелия, рекрутирование ПЯЛ в очаг воспаления, образование активных форм кислорода и перекисное окисление липидов. Основным механизмом действия глюкокортикоидов при активации клеток различными факторами, в частности компонентами микроорганизмов, является подавление транскрипции или трансляции мРНК, кодирующих цитокины. Под влиянием стимулов происходит транслокация ядерного фактора kВ из цитоплазмы в ядро, где и индуцируется траскрипциия различных иммунорегуляторных генов. Воздействие глюкокортикоидов повышает синтез белка I kВa, являющегося цитоплазматическим ингибитором фактора kВ. Взаимодействие фактора kВ с его ингибитором приводит к подавлению транслокации и соответственно синтеза цитокинов [12].
Новая группа 21-аминокортикостероидов, представителем которой является терилазад мезилат, по сравнению с "классическими" кортикостероидами оказывает быстрое прямое подавляющее действие на перекисное окисление липидов и характериззуется мембраностабилизирующим эффектом [12].
В последнее время появилось большое число публикаций, посвященных роли оксида азота в организме, являющегося полифункциональным регулятором сосудистого тонуса, системной гемодинамики, выполняющего роль нейротрансмиттера, иммуномодулятора, участвующего в инактивации ряда металлосодержащих ферментов, оказывающего бактерицидное действие на внутриклеточные микроорганизмы, влияющего на апоптоз и т.д [13, 14]. С точки зрения участия оксида азота в процессах воспаления заслуживет внимания его роль как фактора поддержания сосудистого тонуса и перекисного окисления липидов. Взаимодействие оксида азота с супероксиданионом вызывает образование пероксинитрита, который является прооксидантом белков, липидов и нуклеиновых кислот. При эндотоксическом шоке происходит повышенное выделение оксида азота, что вызывает резкое снижение артериального давления и усиление проницаемости сосудистой стенки. Проведенное на 32 больных с септическим шоком изучение влияния ингибиторов синтетазы оксида азота показало перспективность дальнейших исследований в этом направлении [6].
В заключение следует отметить, что важной предпосылкой дальнейшей оптимизации схем эффективной комбинированной адьювантной патогенетической терапии является изучение количественных показателей динамики медиаторов в различные фазы воспаления и влияния на нее фармакологической регуляции. Одним из плодотворных методических подходов к решению этих задач является разработка математических моделей действия цитокинов [8].
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 2000-N12, стр. 17-22.
1. Никитин А.В., Навашин П.С, Смолкина Т.В. Влияние современных химиотерапевтических препаратов на активность фагоцитов и реакции иммунитета. Антибиотики и химиот 1996; 7/8: 49-56.
2. Самсыгина Г.А. Макролиды и фагоцитоз. Там же 1999; 2: 33-36.
3. Никитин А.В. Антибиотики как регуляторы механизмов воспалительных реакций организма при инфекционном процессе. Там же 1998; 9: 3-4.
4. Вядро М.М. Цитокины и их роль в патогенезе и терапии инфекций. Там же 1990; 9: 12-14.
5. Wilson M., Seymour R.,Henderson B. Bacterial perturbations of cytokines networks. Infect Immun 1998; 66:6: 2401-2409.
6. Smith A. Treatment of septic shock with immunotherapy. Pharmacotherapy 1998; 18: 3: 565-580.
7. Dominique E.,Galanaud P. Therapeutique ciblees sur le reseau des cytokines. Med. Тher.1999;.5: 2: 109-113.
8. van Furth A.M.,Roord J.J.,van Furth R. Roles of proinflammatory and anti-inflammatory cytokines in pathophisiology of bacterial meningitis and effect adjunctive therapy. Infect Immun 1996; 64:12: 4883-4890.
9. Chikanza I.C., Jawed S., Naughton D.,Blake D.R. Why do we need new treatments for rheumatoid arthritis?.J.Pharm.Pharmacol.1998; 50: 4: 357-369.
10. Dick A.D. Experimental approaches to specific immunotherapies in autoimmune disease: future treatment of endogenous posterior uveitis? Brit J.Ophtalmol 1995; 79: 1: 81-88.
11. Teixeira M.M.,Gristwood R.W.,Cooper N., Hellewell P.G. Phosphodiesterase(PDE) 4 inhibitors:anti-inflammatory drugs of the future? TIPS 1997; 18: 5: 164-171.
12. Chiara O., Padalino P., Fattori L. et al. Classical corticosteroids and new lipid peroxidation inhibitors in the therapy of multiple organ faillure(MOF). Minerva Сhir 1997; 52: 9: 1095-1102.
13. Ванин А.Ф. Биологическая роль оксида азота:история, современность и перспективы для исследований. Биохимия 1998; 63: 7: 731-733.
14. Кудрин А.В. Микроэлементы и оксид азота - полифункциональные лиганды. Вопр биол мед фарм химии 2000; 1: 3-5.
Написать комментарий
|

