|
Материалы II Международного конгресса по преимплантационной генетике (18-21/IX 1997 г. Чикаго, США)
И.К. Гоголевская
Институт молекулярной биологии им. В.А. Энгельгардта, Москва
Редакция выражает компании <Органон> признательность за возможность использования сети INTERNET-MEDLINE при подготовке этого обзора.
Проблемы репродукции, N1-1999, с.19-26
В начало...
(Окончание)
В настоящее время большое внимание уделяется ПГД 1ПТ и 2ПТ и возникающих при этом проблем с правильной постановкой диагноза. Основная проблема заключается в том, что при тестировании мутации с помощью ПЦР 1ПТ может быть поставлен неправильный диагноз, так как хромосома 1ПТ состоит из двух сестринских хроматид, и статистически на 50% генотип 1ПТ будет гетерозиготным по мутантным генам. Точный диагноз на наличие определенной мутации может быть поставлен при тестировании 2ПТ с гаплоидным числом одиночных хромосом: если мутация детектируется во 2ПТ, значит ее нет в ооците и наоборот.
Но и при проведении ПЦР 1ПТ и 2ПТ возникают, как правило, еще две проблемы:
1) предпочтительная амплификация одного аллеля или выпадение одного аллеля (ADO). На практике для избежания постановки неправильного диагноза, связанного с ADO, проводят амплификацию двух пар высокополиморфных сцепленных маркеров.
2) возможная контаминация образцов ДНК 1ПТ и 2ПТ материнскими фолликулярными клетками или спермальной ДНК.
Хотя в настоящее время ПГД 1ПТ и 2ПТ для серповидно-клеточной анемии и талассемии выполняется только в нескольких центрах [33], она могла бы применяться более интенсивно, если бы это было доступно, как, например, в районе Средиземноморья, где талассемия распространена. Так, на Кипре у более чем четверти супружеских пар после ПГД две беременности или более прерываются вследствие положительного диагноза талассемии, и поэтому за последние несколько лет случаи талассемии у родившихся детей фактически не наблюдаются.
A.Kuliev проводил ПГД на 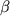 -талассемию в 12 клинических циклах, используя биопсию 1ПТ и 2ПТ, извлеченных из ооцитов во время созревания и оплодотворения, с последующим проведением <гнездового> ПЦР-анализа и рестриктного анализа [34]. Из 118 полученных ооцитов 78 были проверены на наличие мутации в 1ПТ и 2ПТ. Это привело к отбору и переносу 30 нормальных эмбрионов (2,5 эмбриона на цикл). Из-за возможности появления ADO при проведении ПЦР для одной клетки одновременно проводили тестирование двух высокополиморфных маркеров: коротких тандемных повторов (STRs), расположенных непосредственно у 5'-конца -талассемию в 12 клинических циклах, используя биопсию 1ПТ и 2ПТ, извлеченных из ооцитов во время созревания и оплодотворения, с последующим проведением <гнездового> ПЦР-анализа и рестриктного анализа [34]. Из 118 полученных ооцитов 78 были проверены на наличие мутации в 1ПТ и 2ПТ. Это привело к отбору и переносу 30 нормальных эмбрионов (2,5 эмбриона на цикл). Из-за возможности появления ADO при проведении ПЦР для одной клетки одновременно проводили тестирование двух высокополиморфных маркеров: коротких тандемных повторов (STRs), расположенных непосредственно у 5'-конца 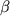 -глобинового гена, и синтеничного короткого тандемного повтора (HUMTHO1). Для установления возможной контаминации образцов ДНК 1ПТ и 2ПТ материнскими фолликулярными клетками или спермальной ДНК также тестировались две системы: для STR локуса на хромосоме 21 и для VWF гена на хромосоме 12. Применяя мультиплексный ПЦР-анализ и сцепленные полиморфные маркеры удалось детектировать ADO в пяти 1ПТ, что помогло избежать переноса анормальных эмбрионов. -глобинового гена, и синтеничного короткого тандемного повтора (HUMTHO1). Для установления возможной контаминации образцов ДНК 1ПТ и 2ПТ материнскими фолликулярными клетками или спермальной ДНК также тестировались две системы: для STR локуса на хромосоме 21 и для VWF гена на хромосоме 12. Применяя мультиплексный ПЦР-анализ и сцепленные полиморфные маркеры удалось детектировать ADO в пяти 1ПТ, что помогло избежать переноса анормальных эмбрионов.
ADO является одним из наиболее возможных объяснений для трех предварительно доложенных случаев неправильно поставленного диагноза для муковисцидоза (CF) при проведении ПГД с помощью биопсии бластомеров, так как все пораженные эмбрионы были сложными гетерозиготами, т.е. мог быть определен только один из двух мутантных аллелей из гетерозиготных бластомеров, проанализированных ПЦР [35].
S.Rechitsky и соавт. [36] исследовали три типа единичных гетерозиготных клеток на присутствие обоих аллелей, включая бластомеры, фибробласты и 1ПТ, полученных от пациентов с риском рождения детей с CF (мутация delta F-508), гемофилией В и серповидно-клеточной анемией. Была введена одновременная амплификация мутантных генов и их сцепленных полиморфных маркеров, таких как 4-нуклеотидный повтор (GATT), расположенный на 3'-конце 6-го интрона в CFTR гене, 4-нуклеотидный повтор (ATTTT) на 5'-конце 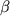 -глобинового гена и HUMTHO1, который является синтеничным с геном -глобинового гена и HUMTHO1, который является синтеничным с геном 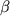 -глобина. Частота ADO была приблизительно в 5 раз выше в бластомерах (33,3%) для delta F-508 мутации и в 3 раза выше для серповидно-клеточной анемии (22,8%) по сравнению с 7,1 и 7,7% для единичных фибробластов и 5,9 и 9,6% для 1ПТ соответственно. Эти результаты были статистически значимыми. Применение одновременной амплификации сцепленных полиморфных маркеров позволило детектировать более половины случаев ADO в бластомерах (19,4% для CF и 12,3% - для -глобина. Частота ADO была приблизительно в 5 раз выше в бластомерах (33,3%) для delta F-508 мутации и в 3 раза выше для серповидно-клеточной анемии (22,8%) по сравнению с 7,1 и 7,7% для единичных фибробластов и 5,9 и 9,6% для 1ПТ соответственно. Эти результаты были статистически значимыми. Применение одновременной амплификации сцепленных полиморфных маркеров позволило детектировать более половины случаев ADO в бластомерах (19,4% для CF и 12,3% - для 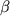 -глобинового гена) и большинство случаев ADO в ПТ. -глобинового гена) и большинство случаев ADO в ПТ.
Комбинирование обоих подходов (сцепленные маркеры и последовательный ПТ анализ) для детекции ADO был применен в 24 клинических циклах ПГД для CF, серповидно-клеточной анемии, гемофилии В и талассемии, что привело к рождению 3 здоровых детей [37]. Последующее изучение эмбрионов, полученных от ооцитов с мутантными аллелями, подтвердило диагноз у 128 из 130 эмбрионов (в 211 из 219 для полиморфных маркеров), демонстрируя тем самым возможность применения и точность постановки диагноза. При этом установлена частота постановки неправильного диагноза приблизительно 1% при одновременном использовании сцепленных маркеров и ПТ-анализа.
Пятикратное повышение частоты ADO в бластомерах по сравнению с ПТ и фибробластами показывает, что не следует использовать биопсию бластомеров для ПГД при рецессивных заболеваниях, когда пациенты являются носителями различных мутаций, X-связанных заболеваний, доминантных заболеваний. Таким образом, вышеизложенные данные показывают, что последовательный ПТ-анализ является предпочтительным методом для ПГД менделевских рецессивных и X-связанных заболеваний, а также при тестировании доминантных заболеваний, когда мать является носителем мутантных аллелей.
Заключение
Итак, ПГД является самой ранней формой пренатальной диагностики, цель которой состоит в том, чтобы не допустить перенос и имплантацию эмбрионов с серьезными генетическими заболеваниями. ПГД в первую очередь предлагается супружеским парам, у которых ожидается повышенная частота появления анеуплоидий, связанная с возрастом матери, а также супружеским парам, имеющим высокий риск рождения детей с нарушениями в единичных генах. Список заболеваний, для которых необходимо проведение ПГД, быстро пополняется и включает возрастные анеуплоидии, муковисцидоз, болезнь Тея-Сакса, гемофилию А и В, пигментный ретинит, серповидно-клеточную анемию, талассемию, синдром Альпорта, синдром ломкой X-хромосомы (синдром Мартина-Белла), миопатию Дюшенна, синдром Леша-Нихена, миотоническую дистрофию, синдром Марфана, хорею Гентингтона, заболевания, связанные с нарушениями в X-хромосоме и т.д. В настоящее время существует 40 ПГД центров в 17 странах, включая США, Бельгию, Англию, Италию, Испанию, Австралию, Израиль, Россию, Белоруссию и т.д. В 28 центрах из 12 стран с применением ПГД выполнено 1200 клинических циклов, приведших к получению 231 беременности (частота беременности 20%) и рождению 166 здоровых детей.
1. Edwards R.G., Gardner R.L. Sexing of live rabbit blastocysts. Nature 1967; 214: 567-577. 2. Saiki R.K. et al. Enzymatic amplification of 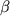 -globin genomicsequences and restriction site analysis for diagnosis of sickle cell anemia. Science 1985; 230: 1350-1354. -globin genomicsequences and restriction site analysis for diagnosis of sickle cell anemia. Science 1985; 230: 1350-1354. 3. Handyside A.H. et al. Pregnancies from biopsied human preimplantation embryos sexed by Y-specific DNA amplification. Nature 1990; 344: 768-770. 4. Harper J.C. et al. Mosaicism of autosomes and sex chromosomes in morphologically normal, monospermic preimplantation human embryos. Prenat Diagn 1995; 15: 41-49. 5. Munne S. et al. Assessment of numeric abnormalities of X,Y,18, and 16 chromosomes in preimplantation human embryos before transfer. Am J Obstet Gynecol 1995; 172: 1191-1201. 6. Delhanty J., Griffin D., Handyside A. et al. Detection of anaploidy and mosaicism in human embryos during preimplantation sex determination by FISH. Hum Mol Genet 1993; 2(8): 1183- 1185. 7. Delhanty J.D.A., Harper J.C. et al. Multicolour FISH frequent chromosomal mosaicism and chaotic division in normal preimplantation embryos from fertile patients. Hum Genet 1997; 99(6): 755-760. 8. Verlinsky Y., Cieslak J. et al. Preimplantation diagnosis of common aneuploidies by the first- and second-polar body Fish analysis. Journal of Assisted Reproduction and Genetics 1998; 15: 5: 285-289. 9. Munne S., Scott R. et al. Pregnancies after preconception testing of Robertsonian translocation of maternal origin. Fertil Steril 1998; (in press). 10. Conn C.M., Harper J.C. et al. Infertility couples with Robertsonian translocation: PGDanalysis of embryos reveals chaotic cleavage divisions. Hum Genet 1998; (in press). 11. Munne S. et al. Spontaneous abortions are reduced after preconception diagnosis of translocations. Journal of Assisted Reproduction and Genetics 1998; 15: 5: 290-296. 12. Magli M.C., Gianaroli L. et al. Incidence of chromosomal abnormalities from a morphologically normal cohort of embryos in poor-prognosis patients. Journal of Assisted Reproduction and Genetics 1998; 15: 5: 297-301. 13. Manor D. et al. Preimplantation diagnosis by FISH: the Rambam experience. Journal of Assisted Reproduction and Genetics 1998; 16: 5: 308-309. 14. Vidal F. et al. FISH preimplantation diagnosis of chromosome aneyploidy in recurrent pregnancy wastage. Journal of Assisted Reproduction and Genetics 1998; 15: 5:310-313. 15. Smith S.E. et al. Simultaneous detection of chromosomes X, Y, 13, 18 and 21 by FISH in blastomeres obtained from preimplantation embryos. Journal of Assisted Reproduction and Genetics 1998; 15: 5: 314-319. 16. Hindkjaer J. et al. Fast, sensitive multicolour detection of nucleic acids in situ, by PRINS. Cytogenet Cell Genet 1994; 66: 152-154. 17. Pellestor F. et al. Preimplantation embryo chromosome analysis by PRINS labeling method. Fertil Steril 1996; 66(5): 781- 786. 18. Findlay I. et al. Fluorescent polymerase chain reaction. A new method allowing genetic diagnosis and DNA fingerprinting of single cells. Hum Reprod 1996; 2(2):137-152. 19. Findlay I. et al. Allelic dropout and preferential amplification in single cells and human blastomers. Hum Reprod 1995; 10(6): 1609-1618. 20 Kotzot D. et al. Isochromosome 18P results from maternal meiosis-II nondisjunction. Eur J Hum Genet 1996; 4: 168-174. 21. Mansfield E.S. Diagnosis of Down syndrom and other aneuploidies using quantitative PCR and small tandem repeat polymorphisms. Hum Mol Genet 1993; 2: 43-50. 22. Findlay I. et al. Rapid trisomy diagnosis (12, 18, and 13 using fluorescent PCR and short tandem repeats: applications for prenetal diagnosis and preimplantation genetic diagnosis. Journal of Assisted Reproduction and Genetics 15: 5: 266-275. 23. Liang P. et al. Differential display of eucaryotic messenger RNA by means of the polymerase chain reaction. Science 1992; 257: 967-971. 24. Daniels R. et al. Transcription of tissue-specific genes in human preimplantation embryos. Hum Reprod 1997; 12: 2251-2256. 25. Daniels R. et al. Expression of the myotonin protein kinase gene in preimplantation human embryos. Hum Mol Genet 1995; 4: 389-393. 26. Сross S.H. et al. CpG islands and genes. Curr Opin Genet Dev 1995; 5: 309-314. 27. Reed M.L. et al. Maternal imprinting of human SNRPN, a gene detected in Prader-Willi syndrome. Nature Genet 1994; 6: 163-167. 28. Adjaye J. et al. cDNA libraries from single human preimplantation embryos. Genomics 1997; 46: 337-344. 29. Adjaye A. et al. The construction of cDNA libraries from human single preimplantation embryos and their use in the study of gene expression during development. Journal of Assisted Reproduction and Genetics 1998; 15: 5: 344-348. 30. Verlinsky Y., Morozov G. et al. Isolation of cDNA libraries from individual human preimplantation embryos. Mol Hum Reprod 1998; (in press). 31. Morozov G. et al. Sequence analysis of libraries from individual human blastocysts. Journal of Assisted Reproduction and Genetics 1998; 15: 5: 338-343. 32. Blaszczyk A. et al. Preimplantation genetic diagnosis of human embryos for Marfan's syndrom. Journal of Assisted Reproduction and Genetics 15: 5: 281-284. 33. Modell B. et al. Community Genetics Services in Europe. Copenhagen, World Health Organization, Regional Office for Europe, Copenhagen, 1991; 137. 34. Kuliev A. Preimplantation diagnosis of thalassemias. Journal of Assisted Reproduction and Genetics 1998; 15: 5: 219-225. 35. Verlinsky Y. et al. Preimplantation diagnosis of genetic and chromosomal diseases. Journal of Assisted Reproduction and Genetics 1994; 11: 236-243. 36. Rechitsky S. et al. Allele dropout in polar bodies and blastomeres. Journal of Assisted Reproduction and Genetics 1998; 15: 5: 253-257. 37. Verlinsky Y. et al. Preimplantation diagnosis of single gene disorder by two-step oocyte genetic analysis using first and second polar body. Biochem Mol Med 1997; 62: 182-187.
Написать комментарий
| 
